
【题目】某研究小组向某2 L密闭容器中加入一定量的固体A和气体B,发生反应
A(s)+2B(g) ![]() D(g)+E(g) ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
D(g)+E(g) ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T 1 ℃时,该反应的平衡常数K=________。
(2)30 min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是________(填字母编号)。
a.通入一定量的B
b.加入一定量的固体A
c.适当缩小容器的体积
d.升高反应体系温度
e.同时加入0.2 mol B、0.1 mol D、0.1 mol E
(3)对于该反应,用各物质表示的反应速率与时间的关系示意曲线为图1中的________(填序号)。

(4)维持容器的体积和温度T1 ℃不变,若向该容器中加入1.60 mol B、0.20 mol D、0.20 mol E和n mol A,达到平衡后,与表格中20分钟时各物质的浓度完全相同,则投入固体A的物质的量n的取值范围是________。
(5)维持容器的体积和温度T1 ℃不变,各物质的起始物质的量为:n(A)=1.0 mol,n(B)=3.0 mol,n(D)=a mol,n(E)=0 mol,达到平衡后,n(E)=0.50 mol,则a=________。
(6)若该密闭容器绝热,实验测得B的转化率B% 随温度变化的示意图如图2所示。由图可知,Q_______0(填“大于”或“小于”),c点v正_______v逆(填“大于”、“小于”或“等于”)。
【答案】0.25ae④大于0.3(或>0.3)1.5小于等于
【解析】
(1)平衡时生成物的浓度幂之积之反应物浓度的幂之积;(2)由图可知反应体系反应物和生成物的物质的量都增加;(3)依据化学反应达到平衡的过程分析和反应速率变化判断,达到平衡状态反应是可逆反应,正逆反应速率相同,速率之比等于化学方程式计量数之比;(4)由提供的数据可知,与表格中20分钟时各物质的浓度完全相同时,所以生成D、E的量为0.5-0.2=0.3mol,A的量要够转化所以A的量不小于0.3mol;(5)温度不变平衡常数不变,来求a的值;(6)最高点达平衡状态,温度升高B的转化率减小,所以正反应是放热反应。
(1)由表可知40分钟达平衡状态,结合平衡浓度和平衡常数概念计算,所以K=![]() =0.25;(2)30nim后,BDE都增加,由图可知反应体系反应物和生成物的物质的量都增加,可能增大反应物B的量,平衡正向移动,导致反应物和生成的物质的量都增加,或按变化量同时改变反应物和生成物,a.通入一定量的B平衡正向进行,BDE增大,故a符合;b.加入一定量的固体A不影响平衡移动,BDE不变,故b不符合;c.反应前后气体体积不变,适当缩小容器的体积,平衡不动,故c不符合;d.反应是吸热反应,升高反应体系温度,平衡正向进行,B减小,故d不符合;e.同时加入0.2molB、0.1molD、0.1molE,BDE浓度增大,故e符合;故选:ae;(3)A(s)+2B(g)
=0.25;(2)30nim后,BDE都增加,由图可知反应体系反应物和生成物的物质的量都增加,可能增大反应物B的量,平衡正向移动,导致反应物和生成的物质的量都增加,或按变化量同时改变反应物和生成物,a.通入一定量的B平衡正向进行,BDE增大,故a符合;b.加入一定量的固体A不影响平衡移动,BDE不变,故b不符合;c.反应前后气体体积不变,适当缩小容器的体积,平衡不动,故c不符合;d.反应是吸热反应,升高反应体系温度,平衡正向进行,B减小,故d不符合;e.同时加入0.2molB、0.1molD、0.1molE,BDE浓度增大,故e符合;故选:ae;(3)A(s)+2B(g)![]() D(g)+E(g)△H=QkJ/mol;反应前后气体体积不变;①B的反应速率不能为0;②B的反应速率和DE反应速率达到平衡状态不能相同;③DE变化速率 相同,图象不符;④DE速率相同,图象表示的是逆向进行,B反应速率增大,DE反应速率减小,故④正确;故答案为:④;(4)由提供的数据可知,与表格中20分钟时各物质的浓度完全相同时,所以生成D、E的量为0.5-0.2=0.3mol,A的量要够转化所以A的量不小于0.3mol,大于等于0.3mol;
D(g)+E(g)△H=QkJ/mol;反应前后气体体积不变;①B的反应速率不能为0;②B的反应速率和DE反应速率达到平衡状态不能相同;③DE变化速率 相同,图象不符;④DE速率相同,图象表示的是逆向进行,B反应速率增大,DE反应速率减小,故④正确;故答案为:④;(4)由提供的数据可知,与表格中20分钟时各物质的浓度完全相同时,所以生成D、E的量为0.5-0.2=0.3mol,A的量要够转化所以A的量不小于0.3mol,大于等于0.3mol;
(5) A(s)+2B(g)![]() D(g)+E(g)
D(g)+E(g)
起始量 3.0mol amol 0mol
平衡量 3-0.5×2 a+0.50 0.50mol
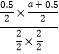 =0.25,解得a=1.5;(6)最高点达平衡状态,温度升高B的转化率减小,所以正反应是放热反应,即Q小于0,故答案为:小于;等于。
=0.25,解得a=1.5;(6)最高点达平衡状态,温度升高B的转化率减小,所以正反应是放热反应,即Q小于0,故答案为:小于;等于。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】下列反应属于吸热反应的是( )
A. C6H12O6(葡萄糖aq)+6O2![]() 6CO2+6H2O
6CO2+6H2O
B. 氢氧化钠溶液与盐酸的中和反应
C. 反应物的总能量大于生成物的总能量
D. 破坏反应物全部化学键所需能量大于破坏生成物全部化学键所需能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:

回答下列问题:.
(1)固体1含有的物质是_________、CaCO3、Ca(OH)2;捕获剂所捕获的气体主要是_______________。
(2)若X是空气,则上述反应中NO和O2的物质的量之比最好为___________,若空气过量,导致的结果会是____________________________。
(3)流程中处理含NH4+废水时发生反应的离子方程式为____________________________。气体1也可通过催化剂直接转化成无污染气体,反应的化学方程式为_____________________________________。
(4)若工业废气中主要含N2、SO2,不考虑其他成分,则可用下列工艺生产NaHSO3过饱和溶液[NaHSO3过饱和溶液是生产焦亚硫酸钠(Na2S2O5)的原料]。
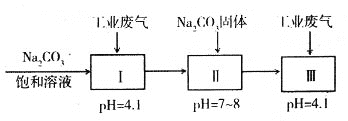
pH=4.1时,I中反应的化学方程式为_________________________;工艺中加入Na2CO3
固体、并再次通入废气的目的是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中进行的反应为 X(g)+3Y(g) ![]() 2Z(g),X、Y、Z 的起始浓度依次为0.1 mol / L,0.3 mol / L,0.2 mol / L,当反应达平衡时,各物质的浓度可能是 ( )
2Z(g),X、Y、Z 的起始浓度依次为0.1 mol / L,0.3 mol / L,0.2 mol / L,当反应达平衡时,各物质的浓度可能是 ( )
A. X=0.2 mol / L,Y=0.6 mol / L B. Y=0.5 mol / L或Y=0.1 mol / L
C. Y=0.6 mol / L D. Z=0.4 mol / L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)。当SO2、O2、SO3的浓度不再变化时,下列说法正确的是
2SO3(g)。当SO2、O2、SO3的浓度不再变化时,下列说法正确的是
A. 该反应已达化学平衡状态B. 正、逆反应速率相等且等于零
C. SO2和O2全部转化为SO3D. SO2、O2、SO3的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在下列有机化合物①CH4、②CH2=CH2、③CH3CH2OH④CH3COOH⑤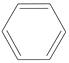 中,可用作医用消毒剂的是_________(填序号,下同),可作为水果催熟剂的是_________,从煤干馏产物中可获得的液态化工原料是_________,可清除水壶中水垢的是_________,可作清洁燃料的是_________。
中,可用作医用消毒剂的是_________(填序号,下同),可作为水果催熟剂的是_________,从煤干馏产物中可获得的液态化工原料是_________,可清除水壶中水垢的是_________,可作清洁燃料的是_________。
(2)化石燃料包括________、__________、_________。三大合成材料包括_____、_______、______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应达到最大反应限度的本质特征是( )
A.正反应不再继续进行
B.正反应和逆反应都再继续进行
C.正反应和逆反应的速率都为零
D.正反应和逆反应的速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,将体积为Va、pH=a的某一元酸HA溶液与体积为Vb、pH=b的某一元碱BOH溶液混合,请回答。
(1)若a + b=14,2Va=Vb,反应后所得溶液pH=7。则生成的盐溶液中,一定发生水解的离子方 程式为_______
(2)若a + b=12,酸是盐酸,碱是KOH,反应后所得溶液pH=7,则Va与Vb的关系是_______
(3)若酸是盐酸,碱是氨水,反应后所得溶液中离子浓度大小关系不可能是_________(填序号)
A.c(Cl-)>c(NH)>c(H+)>c(OH-) B.c(H+)>c(OH-)>c(Cl-)>c(NH)
C.c(NH)>c(Cl-)>c(OH-)>c(H+) D.c(Cl-)>c(H+)>c(NH)>c(OH-)
E.c(Cl-)=c(NH)>c(H+)=c(OH-)
(4)若酸是醋酸,碱是NaOH,且反应后混合溶液中c(CH3COO-)>c(H+),则混合溶液可能呈_____(填序号)
A.酸性 B.碱性 C.中性 D.都有可能
(5)25 ℃时,将体积Va=200 mL,pH=2的H2SO4溶液与体积Vb=10 mL、pH=11的氨水溶液混合,恰好完全反应。则此条件下,氨水的电离平衡常数是____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程因发生取代反应而产生的是( )
A.乙烯使溴的四氯化碳溶液退色
B.将苯加入溴水中,振荡后水层接近无色
C.将苯、浓硫酸、浓硝酸混合后在55~60 ℃ 水浴中加热
D.液态植物油与氢气反应生成固态物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com