
(19分)运用化学反应原理研究碳、氮、硫等单质及其化合物的反应有重要意义;
(1)甲醇是重要的可再生燃料。已知在常温常压下:

则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_________。
(2)利用催化氧化反应将转化为是工业上生产硫酸的关键步骤.
①一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生上述反应,能说明该反应已达到平衡状态的是________。
a.体系的密度不发生变化
b.体系中硫元素的质量百分含量不再变化
c.SO2与SO3的体积比保持不变
d.容器内的气体分子总数不再变化
e.单位时问内转移4 mol电子,同时消耗2molSO3
②T℃时,在1L密闭容器中充入0.6 molSO3,下图表示SO3物质的量随时间的变化曲线。达到平衡时,用SO2表示的化学反应速率为________;SO3的转化率为________(保留小数点后-位):T℃时,反应 的平衡常数为_______;T℃其他条件不变,在8min时压缩容器体积至0.5 L,则n(SO3)的变化曲线为________(填字母)。
的平衡常数为_______;T℃其他条件不变,在8min时压缩容器体积至0.5 L,则n(SO3)的变化曲线为________(填字母)。

(3)有人设想以N2和H2为反应物,以溶有A物质的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。

电池正极的电极反应式是_____电解质溶液的pH______(填写增大、减小、不变),A.物质是______(写化学式)。
(1)CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ·mol-1
(2)①cd②0.05mol·L-1·min-1;66.7%;1.25L·mol-1;c
(3)N2+8H++6e-=2NH4+;增大;NH4Cl
【解析】
试题分析:(1)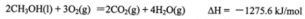 ①
①
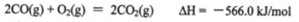 ②
②
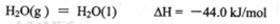 ③
③
ΔH=(①-②+4③)/2=(-1275.6+566.0-4×44.0)/2=-442.8kJ/mol
故热化学方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)ΔH=-442.8kJ/mol
(2)①证明反应达到平衡状态的标志是各组分物质的量、物质的量浓度、体积分数、分子总数等不随时间的变化而变化,故选择cd。
②由图可知,当t=8min时反应达到平衡,那么v(SO3)=v(SO2)=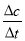 =
=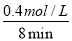 =0.05mol/(Lmin)
=0.05mol/(Lmin)
ω= =
=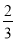 =66.7%
=66.7%
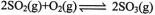
始000.6
转0.40.20.4
平0.40.20.2K=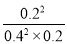 =1.25L/mol
=1.25L/mol
在8min时,压缩容器体积至0.5L,相当于增大压强,平衡向体积缩小的方向移动,即平衡向着生成SO3的方向移动,所以选择曲线c。
(3)以N2和H2为反应物,以溶有A物质的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,由图可知H2为负极,N2为正极,正极的电子,电极反应为N2+8H++6e-=2NH4+;由于H+被消耗,pH值增大;正极产生NH4+,与电解质溶液中的Cl-相结合,形成NH4Cl。
考点:热化学方程式的书写,化学反应速率与化学平衡,原电池的相关知识
考点分析: 考点1:化学反应与能量 考点2:电化学基础 考点3:化学平衡状态及移动 试题属性

 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源:2014-2015学年北京市海淀区高三年级3月适应性训练理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.银氨溶液可以用于区分麦芽糖和蔗糖
B.乙醇、乙二醇、丙三醇的沸点依次升高
C.1mol乙酰水杨酸( )最多可以和2mol NaOH反应
)最多可以和2mol NaOH反应
D.可用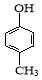 和HCHO 为原料合成
和HCHO 为原料合成
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省文登市高三第二次统考理科综合化学试卷(解析版) 题型:填空题
(20分)近年来大气问题受到人们越来越多的关注。按要求回答下列问题:
Ⅰ.实现反应CH4(g)+CO2(g) 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。
2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。

则p1、p2、p3、p4由大到小的顺序 ,该反应的正反应是______(填“吸热”或“放热”)反应,当1000℃甲烷的转化率为80%时,该反应的平衡常数K=________。
Ⅱ.PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx。
(1)处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(g) △H1=-574kJ·mol-1
CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H2=-1160kJ·mol-1
CH4(g) + 2NO2 (g) = N2(g) + CO2(g) + 2H2O(g) △H3
则△H3= ,如果三个反应的平衡常数依次为K1、K2、K3,则K3=__________(用K1、K2表示)
(2)实验室可用NaOH溶液吸收SO2,某小组同学在室温下,用pH传感器测定向20mL0.1mol·L-1NaOH溶液通入SO2过程中的pH变化曲线如图所示。
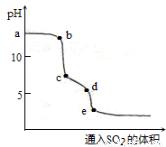
①ab段发生反应的离子方程式为________________。
②已知d点时溶液中溶质为NaHSO3,此时溶液中离子浓度由大到小的顺序为_______,如果NaHSO3的水解平衡常数Kh=1×10-12mol·L-1,则该温度下H2SO3的第一步电离平衡常数Ka=________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省文登市高三第二次统考理科综合化学试卷(解析版) 题型:选择题
如图X、Y、A、B、C均为短周期主族元素,其中只有一种是金属元素,则下列说法错误是
X | A | ||
Y | C | B |
A.原子半径大小:Y > C > X > A
B.Y和B形成的化合物中Y和B的原子个数比为2:3
C.X、C、A中最高价氧化物对应的水化物的酸性最强的是A
D.A、B均为非金属元素,所以两者的氢化物相遇不发生反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三第一次模拟考试理科综合化学试卷(解析版) 题型:选择题
Al、Fe、Cu都是重要的金属元素。下列说法正确的是
A.三者对应的氧化物均为碱性氧化物
B.三者的单质放置在空气中只生成氧化物
C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
D.电解AlCl3、FeCl3、CuCl2的混合溶液在阴极上依次析出Cu、Fe、Al
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三上学期期末考试化学试卷(解析版) 题型:推断题
(7分)已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:

(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为 B反应的化学程式为 。
(2)若A焰色反应为黄色,D 常温下是气体,则 B可能是 (任写一种)。
(3)若D是金属,C溶液在贮存时应加入少量D,其理由是 。
(4)若A是一种黑色非金属单质,D 是氧化物,写出 B与 D 反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.高炉炼铁中焦炭直接还原化合态的铁
B.工业上常用液氨作制冷剂
C.元素分析仪是一种可用于确定化学反应速率的比色分析仪器
D.12C可用于考古断代
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省稳派教育高三一轮复习质量检测理科综合化学试卷(解析版) 题型:选择题
下列关于有机物的说法正确的是
A.乙醇和甘油互为同系物
B.分子式为C7H8O且分子中有苯环的有机物共有4种
C.苯乙烯分子中所有原子可能在同一个平面上
D.除去乙烯中混有的甲烷,可将混合气体通过酸性高锰酸钾溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com