
【题目】(1)在100 mL 0.8mol/L硝酸溶液中加入足量铜粉,则被溶解的铜的质量为____________g。
(2)在上述溶液中再加入足量稀硫酸,又有_______g铜溶解。此过程中生成的气体在标准状况下的体积为_________L。
(3)若向100 mL 0.8mol/L硝酸溶液中加入铁粉,测得反应后的溶液中Fe2+与Fe3+的浓度之比为1:1,则加入铁的质量为____________g。
(4)向100 mL 0.8mol/L硝酸溶液中加入一定量Fe、FeO、Fe2O3的混合物,充分反应后,放出气体224mL(标准状况下),且测得溶液中铁元素只以Fe2+形式存在,为使Fe2+完全沉淀,可向反应后的溶液中加入0.1mol/L的NaOH溶液___________mL。
【答案】(1)1.92;(2)5.76;1.344;(3)1.344;(4)700,
【解析】
试题分析:(1)在100 mL 0.8mol/L硝酸溶液含有硝酸的物质的量为0.08mol,根据3Cu+8HNO3=3Cu(NO3)2 +2NO↑+4H2O,反应的铜的物质的量为0.03mol,质量为0.03mol×64g/mol=1.92g,故答案为:1.92;
(2)根据3Cu+8H++ 2NO3-=3Cu2+ +2NO↑+4H2O,反应的铜的物质的量为![]() ×0.08mol=0.12mol,因此在上述溶液中再加入足量稀硫酸,又有(0.12mol-0.03mol)×64g/mol=5.76g铜溶解。此过程中生成的气体在标准状况下的体积为0.09mol×
×0.08mol=0.12mol,因此在上述溶液中再加入足量稀硫酸,又有(0.12mol-0.03mol)×64g/mol=5.76g铜溶解。此过程中生成的气体在标准状况下的体积为0.09mol×![]() ×22.4L/mol=1.344L,故答案为:5.76;1.344;
×22.4L/mol=1.344L,故答案为:5.76;1.344;
(3)设加入铁的物质的量为x,100 mL 0.8mol/L硝酸溶液含有的硝酸的物质的量为0.08mol,被还原的硝酸的物质的量为0.08mol-![]() ×2-
×2-![]() ×3,根据得失电子守恒,有(0.08mol -
×3,根据得失电子守恒,有(0.08mol - ![]() × 2 -
× 2 - ![]() × 3) × (5-2) =
× 3) × (5-2) = ![]() × 2 +
× 2 + ![]() × 3,解得x=0.024mol,铁的质量为0.024mol×56g/mol=1.344g,故答案为:1.344;
× 3,解得x=0.024mol,铁的质量为0.024mol×56g/mol=1.344g,故答案为:1.344;
(4)HNO3的物质的量为0.1L×0.8mol/L=0.08mol,生成NO的物质的量为:![]() =0.01mol,所以与一定量Fe、FeO和Fe2O3的混合物反应后溶液中含有的NO3-的物质的量为0.08mol-0.01mol=0.07mol,再向反应后的溶液中加入1mol/L的NaOH溶液,要使铁元素全部沉淀下来,所得溶液的溶质为NaNO3,所以需要NaOH的物质的量为:n(NaOH)=n(NO3-)=0.07mol,则所加NaOH溶液的体积最少是
=0.01mol,所以与一定量Fe、FeO和Fe2O3的混合物反应后溶液中含有的NO3-的物质的量为0.08mol-0.01mol=0.07mol,再向反应后的溶液中加入1mol/L的NaOH溶液,要使铁元素全部沉淀下来,所得溶液的溶质为NaNO3,所以需要NaOH的物质的量为:n(NaOH)=n(NO3-)=0.07mol,则所加NaOH溶液的体积最少是![]() =0.7L,即700ml,故答案为:700。
=0.7L,即700ml,故答案为:700。


科目:高中化学 来源: 题型:
【题目】化学上常用燃烧法确定有机物的组成,如下图所示装置是用燃烧法确定烃或烃的含氧衍生物分子式的常用装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。

完成下列问题:
(1)A中发生反应的化学方程式为_______________________________________。
(2)B装置的作用是_______________________________________________,燃烧管C中CuO的作用是______________________________________________________。
(3)产生氧气按从左向右流向,燃烧管C与装置D、E的连接顺序是:C→________→__________。
(4)反应结束后,从A装置锥形瓶内的剩余物质中分离出固体,需要进行的实验操作是_____________。
(5)准确称取 1.8 g 烃的含氧衍生物X的样品,经充分燃烧后,D管质量增加 2.64 g ,E管质量增加 1.08 g ,则该有机物的实验式是___________________________。实验测得X的蒸气密度是同温同压下氢气密度的45倍,则X的分子式为_________________________,1 mol X分别与足量Na、NaHCO 3 反应放出的气体在相同条件下的体积比为1∶1,X可能的结构简式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物A 对氢气的相对密度为29,燃烧该有机物2.9g,生成3.36L二氧化碳气体(密度为1.977g/L)
(1)求该有机化合物的分子式;
(2)取0.58 g该有机化合物与足量银氨溶液反应,析出金属银2.16g。写出该化合物的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是( )
A.![]() N2H4(g)+
N2H4(g)+![]() O2(g)===
O2(g)===![]() N2(g)+H2O(g) ΔH=+267 kJ·mol-1
N2(g)+H2O(g) ΔH=+267 kJ·mol-1
B.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-133.5 kJ·mol-1
C.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=+534 kJ·mol-1
D.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)FeCl3 具有净水作用,但会腐蚀设备,请回答下列问题:
①FeCl3净水的原理是 。FeCl3 溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
②完成NaClO3 在酸性溶液中氧化FeCl2的离子方程式:
![]() ClO3—+
ClO3—+ ![]() Fe2++
Fe2++ ![]() ==
== ![]() Cl-+
Cl-+ ![]() Fe3++
Fe3++![]()
(2)工业上从海带中提碘,常用硫酸酸化的MnO2氧化I—,写出相关的离子方程式 。
(3)下列关系图中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是强酸。当X无论是强酸还是强碱时,都有如下转化关系:当X是强酸时,A、B、C、D、E均含有同一元素:当X是强碱时,A、B、C、D、E均含有另一种元素。回答下列问题:
![]()
①当X是强酸时,写出B生成C的化学方程式 。
②当X是强酸时,写出浓的E溶液与过量的B反应的化学方程式 。
③当X是强碱时,简述检验B气体的操作方法和现象 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B两种烃,含氢的质量分数相同,下列关于A和B的叙述中错误的是 ( )
A.A和B可能是同分异构体
B.A和B不一定是同系物
C.A和B完全燃烧后生成的水的质量相等
D.A和B含碳的质量分数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下图为实验室制备、收集少量HCl的装置。
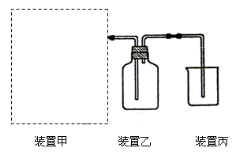
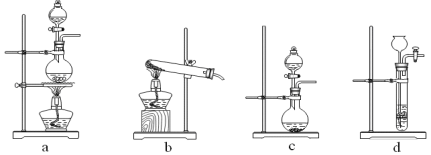
① 制备HCl所用药品为浓硫酸和浓盐酸,则甲的最佳装置应选用下图中的 。
② 请解释能用浓硫酸和浓盐酸制备HCl气体的原因 。
③ 装置丙用来吸收过量的HCl气体,为防止倒吸,则烧杯中应该装入水和 。
(2)以下为苯的取代反应的探究实验。

①按上图所示的装置图连接好各仪器。
②检验装置的气密性。
③在A中加入适量的苯和液溴的混合液体,在B中加入少量铁粉,塞上橡皮塞,打开K1,开始进行反应,放入适量混合液后,关闭K1。
写出B中发生反应的化学方程式 。装置C的作用是 。
④反应结束后,用试管取少量D中的溶液,加入
(描述试剂和现象),则证明B中的取代反应已经发生。
⑤把B中的固液混合物体过滤,分离出液体混合物,按下图方案精制含有苯和溴的溴苯。其中试剂为 ,操作名称为 。
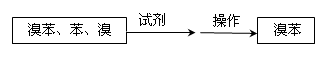
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸二甲酯(简称DMC)是一种绿色化学品,可取代光气等有毒物质作为羰基化或甲基化试剂,如:
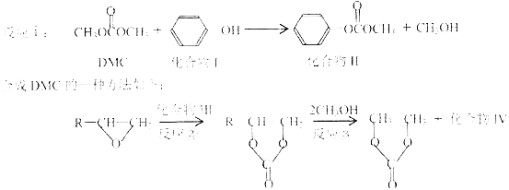
(1)化合物II核磁共振氢谱有 组峰;1mol该物质最多可以跟 mol氢气发生加成反应。
(2)反应①中副产物甲醇发生催化氧化反应的方程式为 。
(3)反应②原子利用率100%,则化合物Ⅲ的名称是 。化合物Ⅳ的结构简式是 ,反应③的反应类型是 。
(4)化合物V是化合物Ⅱ的一种同分异构体,其苯环上的一氯代物有两种,且能发生水解反应和银镜反应,则化合物V的结构简式为(写其中一种) 。
(5)一定条件下,![]() 与DMC 以物质的量之比为1∶1发生类似反应①的反应,请写出该反应的化学方程式 。
与DMC 以物质的量之比为1∶1发生类似反应①的反应,请写出该反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com