
| A. | 如果某化合物只含共价键,则其一定是共价化合物 | |
| B. | 焓变小于0而熵变大于0的反应肯定是自发反应 | |
| C. | 对于给定条件下反应物之间同时发生多个反应的情况,理想的催化剂可以大幅度提高目标产物在最终产物中的比率 | |
| D. | 绿色化学的核心是利用化学原理对产生的环境污染进行治理 |
分析 A.共价化合物只含有共价键;
B.根据△H-T△S<0来判断反应的自发性;
C.催化剂具有选择性;
D.绿色化学的核心是从源头上杜绝污染.
解答 解:A.共价化合物只含有共价键,如含有离子键,则一定为离子化合物,故A正确;
B.焓变小于0而熵变大于0的反应,△H-T△S<0,反应肯定是自发的,故B正确;
C.催化剂只能对主反应即生成目标产物的那个反应起起作用,这样在转化率一定的时候的确目标产物的比例会加大,并不是催化剂对所有反应都能同等程度促进,故C正确;
D.绿色化学的核心是从源头上杜绝污染,故D错误.
故选D.
点评 本题考查较为综合,多角度考查化学键、化学反应与能量、催化剂以及环境污染等知识,侧重于化学与生活、生产、环境的考查,有利于培养学生的良好的科学素养,难度不大.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题

 ;D→E的反应类型取代反应.
;D→E的反应类型取代反应. .
. .
. )的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
)的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH与HCN均为弱酸,酸性:HCN>CH3COOH | |
| B. | 25℃时,水电离出来的c(H+)均为 10-9mol/L的两种酸,酸的浓度:HCN>CH3COOH | |
| C. | 25℃时,浓度均为0.1mol/L 的CH3COONa和NaCN溶液中,pH大小:CH3COONa>NaCN | |
| D. | 25℃时,量取100m LpH=3的CH3COOH溶液加水稀释到1000m L,所得溶液由水电离的c(OH-)>10-10mol/L. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼是新型无机材料中的明星元索.
硼是新型无机材料中的明星元索. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
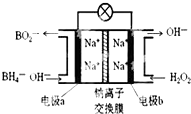 某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )| A. | 电池工作时Na+从b极区移向a极区 | |
| B. | a极上的电极反应式为:BH4-+8OH--8e-=BO2-+6H2O | |
| C. | b极上的电极反应式为:H2O2+2e-+2H+=2H2O | |
| D. | 每消耗3molH2O2,转移3mole- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2015年2月美国研究人员将CO和O附着在一种钌催化剂表面,用激光脉冲将其加热到2000K,成功观察到CO与O形成化学键生成CO2的全过程.下列说法正确的是( )
2015年2月美国研究人员将CO和O附着在一种钌催化剂表面,用激光脉冲将其加热到2000K,成功观察到CO与O形成化学键生成CO2的全过程.下列说法正确的是( )| A. | CO、CO2均属于酸性氧化物 | |
| B. | 形成化学键时需吸收能量 | |
| C. | 钌催化剂可以改变该反应的焓变 | |
| D. | CO与O形成化学键过程中有电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ②④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 2,3,4-三甲基-3-乙基己烷
2,3,4-三甲基-3-乙基己烷 4-甲基-2-戊烯
4-甲基-2-戊烯 乙苯
乙苯


 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com