
 硼是新型无机材料中的明星元索.
硼是新型无机材料中的明星元索. .
.分析 (1)反应物是三溴化硼、三溴化磷和氢气,反应条件是高温,生成物是BP,根据元素守恒知还生成HBr,根据反应物、生成物及反应条件书写方程式;原子晶体的构成微粒是原子,为空间网状结构;根据图知,该晶胞中P原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,P原子含有孤电子对、B原子含有空轨道;
(2)同一周期元素,元素电负性随着原子序数增大而增大;N原子核外有7个电子,根据构造原理书写其基态原子核外电子排布式;氮化硼中N元素化合价为-3价,则B元素化合价为+3价;
(3)环硼氮烷与苯是等电子体.根据苯的结构写出BN的大致结构,再根据一氯代物、二氯代物结构确定N、B原子在环上交叉出现,从而确定其结构简式;
(4)在BF3 分子中,B原子价层电子对个数为3且不含孤电子对,所以为平面正三角形结构,据此计算F-B-F的键角及原子杂化方式,BF4-中B原子价层电子对个数是4且不含孤电子对,其空间构型是正四面体.
解答 解:(1)反应物是三溴化硼、三溴化磷和氢气,反应条件是高温,生成物是BP,根据元素守恒知还生成HBr,根据反应物、生成物及反应条件书写方程式为BBr3+PBr3+3H2$\frac{\underline{\;高温\;}}{\;}$BP+6HBr;原子晶体的构成微粒是原子,为空间网状结构,所以BP是原子晶体;根据图知,该晶胞中P原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,P原子含有孤电子对、B原子含有空轨道,所以提供空轨道的原子是B原子,
故答案为:BBr3+PBr3+3H2$\frac{\underline{\;高温\;}}{\;}$BP+6HBr;原子晶体;4;B;
(2)同一周期元素,元素电负性随着原子序数增大而增大,所以N元素电负性较大;N原子核外有7个电子,根据构造原理书写其基态原子核外电子排布式为1s22s22p3;氮化硼中N元素化合价为-3价,则B元素化合价为+3价,
故答案为:N;1s22s22p3;+3;
(3)环硼氮烷与苯是等电子体.根据苯的结构写出BN的大致结构,再根据一氯代物、二氯代物结构确定N、B原子在环上交叉出现,从而确定其结构简式为 ,故答案为:
,故答案为: ;
;
(4)在BF3 分子中,B原子价层电子对个数为3且不含孤电子对,所以为平面正三角形结构,所以F-B-F的键角为120度,原子杂化方式为sp2,BF4-中B原子价层电子对个数是4且不含孤电子对,其空间构型是正四面体,故答案为:120;sp2;正四面体.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子杂化方式判断、微粒空间构型判断、原子核外电子排布等知识点,利用均摊法、价层电子对互斥理论、构造原理分析解答即可,难点是(3)题结构简式判断.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源:2017届湖南省长沙市高三上学期第三次月考模拟化学试卷 题型:推断题
有机物A~M有如图所示转化关系,A与F分子中所含碳原子数相同,且均能与NaHCO3溶液反应;F的分子式为C9H10O2,且不能使溴的CCl4溶液褪色;D能发生银镜反应;M与足量的NaOH溶液反应后的产物,其一氯代物只有一种。
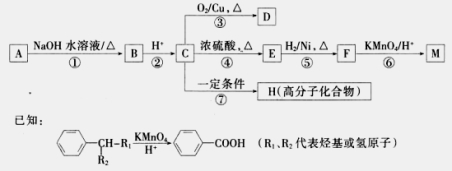
请回答:
(1)B、F的结构简式分别为____________、。
(2)反应①~⑦中,属于氧化反应的是________(填反应序号)。
(3)写出反应④的化学方程式__________________。
(4)D与新制Cu(OH)2悬浊液反应的化学方程式为_______________________。
(5)A的相对分子质量在180~260之间,从以上转化中不能确认A中的某一官能团,下列确定该官能团的哪些实验方法是正确的________。
A.取少量A于试管中,再加入苯振荡,观察分液后上层溶液颜色
B.取少量A于试管中,再加入NaOH溶液共热,待冷却后加入稀硝酸调节至酸性,最后滴入AgNO3溶液,观察沉淀颜色
C.取少量A于试管中,再滴入AgNO3溶液,再加入稀硝酸.观察沉淀颜色
D.取少量A于试管中,再加入NaOH的醇溶液共热,待冷却后加入稀硝酸调节至酸性,最后滴入AgNO3溶液,观察沉淀颜色
(6)符合下列条件的F的同分异构体共有______种。
A.能发生银镜反应
B.能与FeCl3溶液发生显色反应
C.核磁共振氢谱上有四个峰,其蜂面积之比为l:1:2:6
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
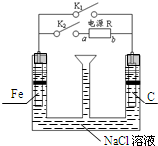
| A. | 若只关闭K1,则Fe发生析氢腐蚀 | |
| B. | 先只关闭K1,漏斗内液面下降,且有红褐色沉淀产生;再打开K1,仅关闭K2,则液面上升 | |
| C. | 若只关闭K2,只有一个电极产生气体,则a为电源负极 | |
| D. | 只关闭K1时,发生的总反应方程式为:2Fe+O2+2H2O═2Fe(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .写出反应 ②的化学方程式
.写出反应 ②的化学方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,属于分子晶体(填晶体类型).
,属于分子晶体(填晶体类型).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果某化合物只含共价键,则其一定是共价化合物 | |
| B. | 焓变小于0而熵变大于0的反应肯定是自发反应 | |
| C. | 对于给定条件下反应物之间同时发生多个反应的情况,理想的催化剂可以大幅度提高目标产物在最终产物中的比率 | |
| D. | 绿色化学的核心是利用化学原理对产生的环境污染进行治理 |
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第三次月考模拟化学试卷 题型:选择题
A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如图所示。
则下列说法正确
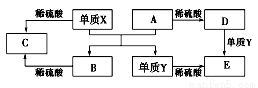
A.单质X与A反应的化学方程式:Al2O3+2Fe Fe2O3+2Al
Fe2O3+2Al
B.检验D溶液中金属阳离子的反应:Fe3++3SCN-=Fe(SCN)3↓
C.单质Y在一定条件下能与水发生置换反应
D.由于化合物B和C均既能与酸反应.又能与碱反应,所以两者均是两性化合物
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | HX | HY | H2CO3 |
| 电离平衡常数 | 7.8×10-9 | 3.7×10-15 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | HX、HY两种弱酸的酸性:HX<HY | |
| B. | 相同条件下溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 | |
| C. | 结合H+的能力:CO32->Y->X->HCO3- | |
| D. | HX与Na2CO3反应,无气泡产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com