
| 弱酸化学式 | HX | HY | H2CO3 |
| 电离平衡常数 | 7.8×10-9 | 3.7×10-15 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | HX、HY两种弱酸的酸性:HX<HY | |
| B. | 相同条件下溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 | |
| C. | 结合H+的能力:CO32->Y->X->HCO3- | |
| D. | HX与Na2CO3反应,无气泡产生 |
分析 相同温度下,相同浓度的酸溶液中,酸的电离平衡常数越大,其电离程度越大,酸的酸性越强,其阴离子的水解能力越弱,据此分析解答.
解答 解:A.相同温度下,相同浓度的酸溶液中,酸的电离平衡常数越大,其电离程度越大,酸的酸性越强,所以这两种弱酸的酸性HX>HY,故A错误;
B.相同条件下,酸的酸性越强,其阴离子的水解能力越弱,相同浓度的钠盐溶液的pH越小,相同条件下溶液的碱性Na2CO3>NaY>NaX>NaHCO3,故B错误;
C.相同条件下,酸的酸性越强,其阴离子的水解能力越弱,即阴离子结合氢离子能力越弱,所以结合H+的能力:Y->CO32->X->HCO3-,故C错误;
D.相同条件下,H2CO3的酸性大于HX,HX的酸性大于HCO3-,HX与Na2CO3反应生成NaX和NaHCO3,无气体生成,故D正确;
故选D.
点评 本题考查了弱电解质的有关知识,明确相同条件下酸的电离程度与酸性强弱、酸根离子的水解能力之间的关系即可解答,难度中等.


科目:高中化学 来源: 题型:解答题
 硼是新型无机材料中的明星元索.
硼是新型无机材料中的明星元索. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 2,3,4-三甲基-3-乙基己烷
2,3,4-三甲基-3-乙基己烷 4-甲基-2-戊烯
4-甲基-2-戊烯 乙苯
乙苯


 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 | 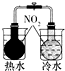 | 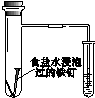 | 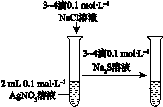 |
| 验证化学能 转化为电能 | 证明温度 对平衡移动的影响 | 验证铁发生析氢腐蚀 | 验证AgCl 溶解度大于Ag2S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 | |
| C. | 相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
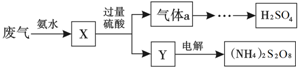
| A. | X可能含有2种盐 | |
| B. | 气体a通入双氧水,可实现“绿色”转化 | |
| C. | Y主要含有(NH4) 2SO4,回收利用作化肥 | |
| D. | (NH4) 2S2O8中S的化合价为+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
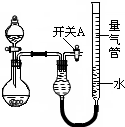 某同学设计如图所示装置分别进行探究实验(夹持装置已略去)
某同学设计如图所示装置分别进行探究实验(夹持装置已略去)| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| ① | Cu、稀HNO3 | H2O | |
| ② | NaOH固体、浓氨水 | NH3 | |
| ③ | Na2CO3固体、稀H2SO4 | CO2 | |
| ④ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| 1 | 1.0g | 10.0mL | 347.5mL |
| 2 | 1.0g | 10.0mL | 335.0mL |
| 3 | 1.0g | 10.0mL | 344.5mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| A | 原子半径是周期表所有元素中最小的 |
| B | 单质常温下为双原子分子,其氢化物水溶液使酚酞变红 |
| C | 基态原子核外S能级上有电子,且p能级上只有一个轨道排满 |
| D | 同周期中电负性最小 |
| E | E的族序数与周期数之差为4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com