
| A. | CH3COOH与HCN均为弱酸,酸性:HCN>CH3COOH | |
| B. | 25℃时,水电离出来的c(H+)均为 10-9mol/L的两种酸,酸的浓度:HCN>CH3COOH | |
| C. | 25℃时,浓度均为0.1mol/L 的CH3COONa和NaCN溶液中,pH大小:CH3COONa>NaCN | |
| D. | 25℃时,量取100m LpH=3的CH3COOH溶液加水稀释到1000m L,所得溶液由水电离的c(OH-)>10-10mol/L. |
分析 25℃时,0.1mol/L 的CH3COOH溶液pH=3,0.1mol/L 的HCN溶液pH=4,说明醋酸和HCN都是弱酸,不能完全电离,且醋酸的酸性比HCN强,弱酸的酸性越弱,其酸根的水解程度越强,相同物质的量的醋酸和HCN中和NaOH的能力相同,据此分析.
解答 解:A、25℃时,0.1mol/L 的CH3COOH溶液pH=3,0.1mol/L 的HCN溶液pH=4,说明醋酸和HCN都是弱酸,不能完全电离,且醋酸的酸性比HCN强,故A错误;
B、醋酸和HCN溶液中氢离子浓度相同时,对水的电离的抑制作用相同,醋酸酸性比较HCN强,当其氢离子浓度相同时,酸的浓度:HCN>CH3COOH,故B正确;
C、醋酸的酸性比HCN强,弱酸的酸性越弱,其酸根的水解程度越强,25℃时,浓度均为0.1 mol/L 的CH3COONa和NaCN溶液中,pH大小:CH3COONa<NaCN,故C错误;
D、醋酸是弱酸,加水稀释能够促进醋酸电离,溶液中氢离子物质的量增大,所以100m LpH=3的CH3COOH溶液加水稀释到1000m L,所得溶液由水电离的c(OH-)<10-10mol/L,故D错误;
故选B.
点评 本题考查了弱酸存在电离平衡,注意弱酸的酸性越弱其电离程度越小,其酸根的水解程度越大,题目难度不大.


科目:高中化学 来源:2017届吉林省长春市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.工业上用石灰乳制备漂白粉:Ca(OH)2+Cl2=Ca2++ClO-+Cl-+H2O
B.向硫酸铝铵溶液中滴加少量Ba(OH)2溶液:NH+Al3++2SO+2Ba2++5OH-=AlO+2BaSO4↓+NH3·H2O+2H2O
C.制备Fe(OH)3胶体:Fe3++3H2O Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
D.用浓盐酸酸化的KMnO4溶液与H 2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
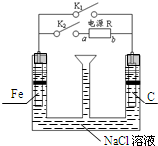
| A. | 若只关闭K1,则Fe发生析氢腐蚀 | |
| B. | 先只关闭K1,漏斗内液面下降,且有红褐色沉淀产生;再打开K1,仅关闭K2,则液面上升 | |
| C. | 若只关闭K2,只有一个电极产生气体,则a为电源负极 | |
| D. | 只关闭K1时,发生的总反应方程式为:2Fe+O2+2H2O═2Fe(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图甲表示反应:4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,K1>K2 | |
| B. | 图乙表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(g)的影响,乙的压强比甲的压强大 | |
| C. | 图丙表示的反应是吸热反应,该图表明催化剂能改变化学反应的焓变 | |
| D. | 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)?N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

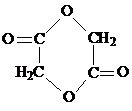 .
. .写出反应 ②的化学方程式
.写出反应 ②的化学方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,属于分子晶体(填晶体类型).
,属于分子晶体(填晶体类型).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果某化合物只含共价键,则其一定是共价化合物 | |
| B. | 焓变小于0而熵变大于0的反应肯定是自发反应 | |
| C. | 对于给定条件下反应物之间同时发生多个反应的情况,理想的催化剂可以大幅度提高目标产物在最终产物中的比率 | |
| D. | 绿色化学的核心是利用化学原理对产生的环境污染进行治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
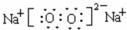 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com