
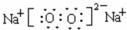 .
.分析 X、Y、Z、R、W为前四周期元素且原子序数依次增大.Z与Y可以形成两种原子个数比分别为1:1和2:1固态化合物,则Z为钠元素,Y为氧元素;Y和R同主族,则R为硫元素;X、R原子中未成对电子数之比为3:2,则X为氮元素,W3+中有5个未成对电子,只能处于第四周期,则W为铁元素,据此答题.
解答 解:X、Y、Z、R、W为前四周期元素且原子序数依次增大.Z与Y可以形成两种原子个数比分别为1:1和2:1固态化合物,则Z为钠元素,Y为氧元素;Y和R同主族,则R为硫元素;X、R原子中未成对电子数之比为3:2,则X为氮元素,W3+中有5个未成对电子,只能处于第四周期,则W为铁元素.
(1)Z和Y原子个数比为1:1的化合物为过氧化钠,它的电子式为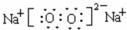 ,
,
故答案为: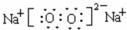 ;
;
(2)W为铁元素,26号元素,它的基态原子的核外电子排布式是 1s22s22p63s23p63d63s2,
故答案为:1s22s22p63s23p63d63s2;
(3)氮原子中2p能级容纳3个电子,为半充满状态,能量较低,所以氮的第一电离能高于相邻的同周期元素,O、S同主族,自上而下第一电离能减小,故第一电离能从小到大的关系为S<O<N,
(4)原子总数相同、价电子总数相同的微粒互为等电子体,与NH3互为等电子体的分子PH3 等、离子有H3O+或等,
故案为:PH3;H3O+;
(4)Fe单质与足量的氧气在点燃条件下充分发生反应,生成一种黑色固体可能为FeO、Fe3O4或二者混合物,为了确定该固体的组成,先将固体溶于足量稀硫酸中,因为所得溶液中有铁离子和亚铁离子,可以通过KSCN溶液呈血红色来检验铁离子的存在,通过KMnO4溶液能褪色,证明亚铁离子的存在,
故答案为:CD;
(5)含氧酸根FeO42-具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,有Fe3+生成,并有无色气体产生,结合电子转移守恒可知,只有氧元素被氧化,故该无色气体为O2,反应离子方程式为:4FeO42-+20 H+=4Fe3++3O2↑+10H2O,
故答案为:4FeO42-+20 H+=4Fe3++3O2↑+10H2O;.
(6)设Cl-的半径为1,则Na+半径为a,Cs+半径为b,氯化钠的晶胞结构如图所示 ,晶胞的边长为2(1+a);氯化铯的晶胞结构为
,晶胞的边长为2(1+a);氯化铯的晶胞结构为 ,晶胞的体对角线长度为2(1+b),则晶胞的边长为$\frac{\sqrt{3}}{3}$×2(1+b),所以氯化钠与氯化铯的晶胞边长比为2(1+a):$\frac{\sqrt{3}}{3}$×2(1+b)=$\frac{\sqrt{3}(1+a)}{(1+b)}$,
,晶胞的体对角线长度为2(1+b),则晶胞的边长为$\frac{\sqrt{3}}{3}$×2(1+b),所以氯化钠与氯化铯的晶胞边长比为2(1+a):$\frac{\sqrt{3}}{3}$×2(1+b)=$\frac{\sqrt{3}(1+a)}{(1+b)}$,
故答案为:$\frac{\sqrt{3}(1+a)}{(1+b)}$.
点评 本题是对物质结构的考查,涉及电子式、原子核外电子排布、等电子体、元素周期律、实验方案的设计、晶胞计算等,具有一定的综合性,解题的关键是元素的推断,注意识记中学常见的晶胞结构,中等难度.


科目:高中化学 来源: 题型:选择题
| A. | CH3COOH与HCN均为弱酸,酸性:HCN>CH3COOH | |
| B. | 25℃时,水电离出来的c(H+)均为 10-9mol/L的两种酸,酸的浓度:HCN>CH3COOH | |
| C. | 25℃时,浓度均为0.1mol/L 的CH3COONa和NaCN溶液中,pH大小:CH3COONa>NaCN | |
| D. | 25℃时,量取100m LpH=3的CH3COOH溶液加水稀释到1000m L,所得溶液由水电离的c(OH-)>10-10mol/L. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ②④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 2,3,4-三甲基-3-乙基己烷
2,3,4-三甲基-3-乙基己烷 4-甲基-2-戊烯
4-甲基-2-戊烯 乙苯
乙苯


 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应Ⅰ的速率增加,反应Ⅱ的速率不变 | |
| B. | 反应Ⅰ的速率不变,反应Ⅱ的速率增加 | |
| C. | 反应Ⅰ、Ⅱ的速率均增加,且反应Ⅰ的速率增加得快 | |
| D. | 反应Ⅰ、Ⅱ的速率均增加,且反应Ⅱ的速率增加得快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 | 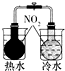 | 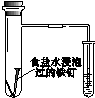 | 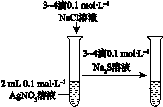 |
| 验证化学能 转化为电能 | 证明温度 对平衡移动的影响 | 验证铁发生析氢腐蚀 | 验证AgCl 溶解度大于Ag2S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 | |
| C. | 相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该  有机物的系统命名为:3-乙基-5-甲基庚烷 有机物的系统命名为:3-乙基-5-甲基庚烷 | |
| B. | 等质量的某烷烃a和某烯烃b,两者完全烧烧后产生的CO2的量有可能a>b | |
| C. |  该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 | |
| D. | 1mol该有机物 在一定条件下与足量NaOH溶液完全反应,最多可消耗NaOH 12mol 在一定条件下与足量NaOH溶液完全反应,最多可消耗NaOH 12mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com