
【题目】短周期元素X、Y、Z组成的化合物Y2X和ZX2.Y2X溶于水形成的溶液能与ZX2反应生成一种化合物Y2ZX3.已知三种元素原子的质子总数为25,且Z和Y的原子序数之和比X的原子序数2倍还多1,Z原子有2个电子层,最外层电子数是核外电子数的![]() 倍,试回答:
倍,试回答:
(1)X元素的名称: ,Y元素在元素周期表中的位置 ,Z元素的原子结构示意图 .
(2)Y2X对应水化物的电子式 ,其中存在的化学键有 .
(3)X的氢化物比同主族的氢化物的熔沸点明显偏高的原因 .
【答案】(1) 氧;第三周期IA族;
(2)![]() ;离子键、共价键
;离子键、共价键
(3)H2O分子之间存在氢键
【解析】试题分析:Z原子有2个电子层,最外层电子数是核外电子数的![]() 倍,令最外层电子数为a,则
倍,令最外层电子数为a,则![]() (2+a)=a,解得a=4,所以Z为C元素;设X原子的质子数为x,Y原子的质子数为y,三种元素原子的质子总数为25,则有6+x+y=25,Z和Y的原子序数之和比X的原子序数2倍还多1,则有6+y=2x+1,联立方程解得:x=8,y=11,即X为氧元素,Y为钠元素。
(2+a)=a,解得a=4,所以Z为C元素;设X原子的质子数为x,Y原子的质子数为y,三种元素原子的质子总数为25,则有6+x+y=25,Z和Y的原子序数之和比X的原子序数2倍还多1,则有6+y=2x+1,联立方程解得:x=8,y=11,即X为氧元素,Y为钠元素。
(1)由上述分析可知,X为氧元素,Y为钠元素,处于周期表中第三周期IA族,Z为碳元素,原子结构示意图为: 。
。
故答案为:氧;第三周期IA族; ;
;
(2)Y2X为Na2O,对应水化物为NaOH,其电子式为:![]() ,含有离子键、共价键。
,含有离子键、共价键。
故答案为:![]() ;离子键、共价键;
;离子键、共价键;
(3)H2O分子之间存在氢键,比同主族的氢化物的熔沸点明显偏高。
故答案为:H2O分子之间存在氢键。


科目:高中化学 来源: 题型:
【题目】化学在生活中有着广泛的应用,下列对应关系错误的是
化学性质 | 实际应用 | |
A. | Al2(SO4)3和小苏打反应 | 泡沫灭火器灭火 |
B. | 铁比铜金属性强 | Fe腐蚀Cu刻制印刷电路板 |
C. | 次氯酸盐具有氧化性 | 漂白粉漂白织物 |
D. | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届石家庄二模】[化学一选修5:有机化学基础]
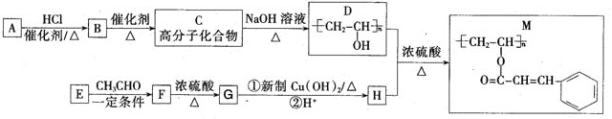
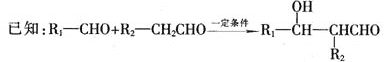
聚乙烯醇肉桂酸酯(M)可用作光刻工艺中的抗腐蚀涂层,其合成路线如下:
-
请回答:
(1)C的化学名称为_______________;M中含氧官能团的名称为_______________。
(2)F-G的反应类型为____ ;检验产物G中新生成官能团的实验方法为__________________
(3)C-D的化学反应方程式为 _______________。
(4)E的结构简式为_______________;H的顺式结构简式为_______________。
(5)同时满足下列条件的F的同分异构体有_______________种(不考虑立体异构);
①属于芳香族化合物 ②能发生水解反应和银镜反应。
其中核磁共振氢谱有4种吸收峰的物质的结构简式为 (任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I (1)某同学做如下实验,以检验反应中的能量变化。
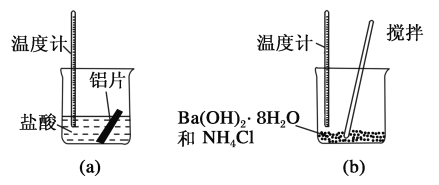
实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是__________热反应;
(b)中温度降低, 根据能量守恒定律,(b)中反应物的总能量应该__________其生成物的总能量。
(2) 下列反应:①氢氧化钠与硫酸,②一氧化碳与氧气,
③八水合氢氧化钡与氯化铵,④金属铜与硝酸银。
其中(用序号填空): 能设计成原电池的反应是____________________。
II(1)有下列几种物质
A.金刚石和石墨 B.C2H6和C5H12 C. C2H4 和 C2H6
D.CH3CH2CH2CH3 和 CH3CH(CH3)2 E.35Cl和37Cl
属于同分异构体的是________;属于同素异形体的是________;
属于同系物的是________; 属于同位素的是________。
(2) 两种粒子的核外电子排布相同,核电荷数不同,则它们可能是________。
A.两种不同元素的原子 B.一定是两种不同的离子
C.同一元素的原子和离子 D.两种不同元素的原子和离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物A含碳77.8%,氢7.40%,其余为氧,A的相对分子质量为甲烷的6.75倍。
(1)试计算确定该有机物的分子式(写出简明计算过程)。
(2)红外光谱测定,A分子结构中含有苯环和羟基。在常温下A可与浓溴水反应,1mol A最多可与2 molBr2作用,据此确定该有机物可能的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如下图所示的装置:
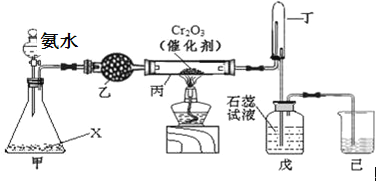
(1)若分液漏斗中氨水的浓度为9.0molL﹣1,配制该浓度的氨水100mL,用到的玻璃仪器有100mL容量瓶、烧杯、玻璃棒、 。
(2)甲装置不需要加热即能同时产生氨气和氧气,烧瓶内固体X的名称为 。
(3)乙装置的作用是 ;写出受热时丙装置发生反应的化学方程式为 。
(4)当戊中观察到 现象,则说明已制得硝酸。某同学按上图组装仪器并检验气密性后进行实验,没有观察到此现象,请分析实验失败的可能原因 。如何改进置 。
(5)改进后待反应结束,将丁装置倒立在盛水的水槽中,会观察到的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地环保部门取一定量某工厂所排废水试样分成甲、乙、丙、丁四份,进行如图所示探究。
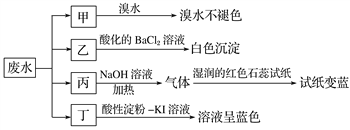
已知废水试样中可能含有下表中的离子:
离子 | |
阳离子 | Na+、Mg2+、X |
阴离子 | Cl-、SO |
请回答下列问题:
(1)离子X是______________(填化学式,下同),离子Y是__________________。
(2)表中不能确定是否存在的阴离子是__________。
(3)写出废水试样中滴加酸性淀粉KI溶液所发生反应的离子方程式: ___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol某烃在氧气中完全燃烧,将生成物全部通入浓硫酸中,浓硫酸增重9 g,继续通入足量的澄清石灰水中,得到沉淀50 g。求:
(1)该有机化合物的分子式
(2)若分子中只有两个甲基且属于不饱和烃,写出其结构简式(任写两种)
、 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com