
【题目】某有机物A的结构简式为 ![]() ,请回答下列问题:
,请回答下列问题:
(1)A中含氧官能团的名称是____;
(2)A可能发生的反应有_____(填序号);
①酯化反应 ②加成反应 ③消去反应 ④水解反应
(3)将A与氢氧化钠的乙醇溶液混合并加热,再让得到的主要产物发生加聚反应,生成了某聚合物,该聚合物的结构简式是_____。
 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:
【题目】锂的化合物用途广泛,如Li3N是非常有前途的储氢材料,氨基锂(LiNH2)主要用于药物制造。在一定条件下,2.30 g固体A与5.35 g NH4Cl固体恰好完全反应,生成固体B和4.48 L气体C(标准状况),气体C极易溶于水得到碱性溶液,电解无水B可生成一种短周期元素的金属单质D和氯气。由文献资料知道:工业上物质A可用金属D与液态的C在硝酸铁催化下反应来制备,纯净的A为白色固体,但制得的粗品往往是灰色的;A的熔点390℃,沸点430℃,密度大于苯或甲苯,遇水反应剧烈,也要避免接触酸、酒精。在空气中A缓慢分解,对其加强热则猛烈分解,在750~800℃分解为Li3N和气体C。
回答下列问题:
(1)C的电子式为 。
(2)将锂在纯氮气中燃烧可制得Li3N,其反应的化学方程式为 。
(3)氮化锂在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:Li3N+2H2![]() LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 (精确到0.1)。
LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 (精确到0.1)。
(4)A在750~800℃分解的方程式 。
(5)亚氨基锂(Li2NH)也是一种储氢容量高,安全性好的固体储氢材料,其储氢原理可表示为Li2NH+H2![]() LiNH2+LiH,下列有关说法正确的是 。
LiNH2+LiH,下列有关说法正确的是 。
A.Li2NH中N的化合价是1 B.该反应中H2既是氧化剂又是还原剂
C.Li+和H的离子半径相等 D.此法储氢和钢瓶储氢的原理相同
(6)久置的A可能大部分变质而不能使用,需要将其销毁。遇到这种情况,可用苯或甲苯将其覆盖,然后缓慢加入用苯或甲苯稀释过的无水乙醇,试解释其化学原理 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是
A. 蒸发时,将蒸发皿放置在铁架台的铁圈上直接用酒精灯外焰加热
B. 蒸馏时,温度计水银球浸入蒸馏烧瓶内液面下,冷凝水从冷凝管下口进
C. 萃取时,分别用两个烧杯从下口接收有机层和水层
D. 配制100ml 0.100 mol/L的硫酸铜溶液时,可将2.50克胆矾溶于100mL蒸馏水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,干燥圆底烧瓶中充满NO2和O2的混合气体进行喷泉实验,经充分反应后,瓶内充满水,则瓶内水溶液的物质的量浓度为
A. 5/112 B. 1/28 C. 2/49 D. 8/245
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A.配制FeCl3溶液时加入少量的盐酸
B.钢铁在潮湿的环境中容易生锈
C.工业合成氨时使用铁触媒为催化剂
D.碳跟氧气反应的实验中增加O2的量可以减少CO的生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液,某学生设计如下实验方案:
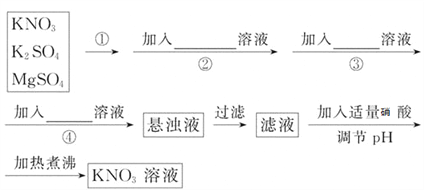
(1)操作①为___________________________。
(2)操作②~④加入的试剂依次可以为:____________________________。
(3)如何判断SO42-已除尽?____________________________。
(4)加热煮沸的目的:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(17分)
羟甲香豆素是一种治疗胆结石的药物,合成路线如下图所示:

已知: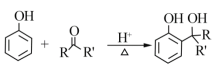
RCOOR'+R'OH![]() RCOOR'+ R'OH(R、R'、R'代表烃基)
RCOOR'+ R'OH(R、R'、R'代表烃基)
(1)A属于芳香烃,其结构简式是______________________。B中所含的官能团是________________。
(2)C→D的反应类型是___________________。
(3)E属于脂类。仅以乙醇为有机原料,选用必要的无机试剂合成E,写出有关化学方程式:______________________________。
(4)已知:2E![]() F+C2H5OH。F所含官能团有
F+C2H5OH。F所含官能团有![]() 和___________。
和___________。
(5)以D和F为原料合成羟甲香豆素分为三步反应,写出有关化合物的结构简式:

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种化工原料,在工业生产中有重要的应用。
Ⅰ.在l.0L恒容密闭容器中投入1 molCO2和2.75molH2发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是_______。
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是_______。


A.该反应的正反应为放热反应
B.压强大小关系为pl<p2<p3
c. M点对应的平衡常数K的值约为1.04×10-2
D.在p2及512K时,图中N点v(正)<v(逆)
Ⅱ.甲醇是基本有机化工原料。甲醇及其可制得的产品的沸点如下。
名称 | 甲醇 | 二甲胺 | 二甲基甲酰胺 | 甲醚 | 碳酸二甲酯 |
结构简式 | CH3OH | (CH3)2NH | (CH3)2NCHO | CH3OCH3 | (CH3O)2CO |
沸点/℃ | 64.7 | 7.4 | 153 | -24.9 | 90 |
(1)在425℃、Al2O3做催化剂,甲醇与氨气反应可以制得二甲胺。二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由大到小的顺序为____________。
(2)甲醇制甲醚的化学方程式为2CH3OH![]() CH3OCH3+H2O,一定温度下,在体积为1.0L的恒容密闭容器中发生该反应。己知387℃时该反应的化学平衡常数K=4,若起始时向容器I中充入0.10molCH3OH、0.15molCH3OCH3和0.10molH2O,则反应将向______(填“正”或“逆”)反应方向进行。
CH3OCH3+H2O,一定温度下,在体积为1.0L的恒容密闭容器中发生该反应。己知387℃时该反应的化学平衡常数K=4,若起始时向容器I中充入0.10molCH3OH、0.15molCH3OCH3和0.10molH2O,则反应将向______(填“正”或“逆”)反应方向进行。
(3)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如下图所示。
电源的负极为__________(填“A”或“B”),写出阳极的电极反应_________;若参加反应的O2为1.12m3(标准状况),则制得的碳酸二甲酯的质量为______kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com