
【题目】下列说法中正确的是

A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
B.元素Ge位于周期表第四周期IVA族,核外电子排布式为 [Ar]4s24p2,属于P区
C.HF晶体沸点高于HCl,是因为 HCl共价键键能小于HF
D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:v(H2O2)≈3.3×10-2mol·L-1·min-1
B.0~4min的平均反应速率:v(H2O2)>3.3×10-2mol·L-1·min-1
C.反应至6 min时,H2O2分解了50%
D.反应至6 min时,c(H2O2)=0.25 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时,将nmol/L的氨水滴入10mL0.1mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是
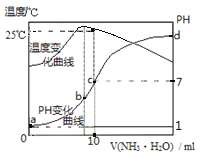
A.a点KW=1.0×10-14
B.水的电离程度:b>c>a>d
C.b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D.25℃时,一水合氨的电离平衡常数为10-7/(10n-1)(用n表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)=2C(g),反应过程中C的百分含量与温度关系如图,下列正确的是

A.正反应速率:v(c)>v(d)>v(b)
B.化学平衡常数:K(d)>k(c)
C.c向d变化时,v(正)<v(逆)
D.d点状态加入合适的催化剂可使c%增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、镁及其化合物在工农业生产中应用广泛.已知:硼镁矿主要成分为![]() ,硼砂的化学式为
,硼砂的化学式为![]() 利用硼镁矿制取金属镁及粗硼的工艺流程如下.
利用硼镁矿制取金属镁及粗硼的工艺流程如下.

回答下列有关问题.
(1)硼砂中B的化合价为 ______,溶于热水后,常用![]() 调pH到
调pH到![]() 制取
制取![]() ,反应的离子方程式为 ______,X为
,反应的离子方程式为 ______,X为![]() 晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为 ______,该反应中的氧化剂是 ______ (填化学式)。
晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为 ______,该反应中的氧化剂是 ______ (填化学式)。
(2)硼酸是一种一元弱酸,它与水作用时结合水电离的![]() 而释放出水电离的H+,这一变化的化学方程式为 ______,皮肤上不小心碰到氢氧化钠溶液,一般先用大量水冲洗,然后再涂上硼酸溶液,则硼酸与氢氧化钠反应的离子方程式为 ______。
而释放出水电离的H+,这一变化的化学方程式为 ______,皮肤上不小心碰到氢氧化钠溶液,一般先用大量水冲洗,然后再涂上硼酸溶液,则硼酸与氢氧化钠反应的离子方程式为 ______。
(3)![]() 需要在HCl氛围中加热制
需要在HCl氛围中加热制![]() ,其目的是 ______ .
,其目的是 ______ .
(4)制得的粗硼在一定条件下生成![]() ,
,![]() 加热分解可以得到纯净的单质硼.现将
加热分解可以得到纯净的单质硼.现将![]() 粗硼制成的
粗硼制成的![]() 完全分解,生成的
完全分解,生成的![]() 用
用![]() 为弱酸
为弱酸![]() 溶液滴定至终点,消耗
溶液滴定至终点,消耗![]() 溶液
溶液![]() 盛装
盛装![]() 溶液的仪器应为 ______
溶液的仪器应为 ______ ![]() 填“酸式”或“碱式”
填“酸式”或“碱式”![]() 滴定管.该粗硼样品的纯度为 ______ (提示:
滴定管.该粗硼样品的纯度为 ______ (提示:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 四种离子两两组成四种可溶性盐,室温下,AC和BD的盐溶液的
四种离子两两组成四种可溶性盐,室温下,AC和BD的盐溶液的![]() ,BC盐溶液
,BC盐溶液![]() ,则下列说法正确的是
,则下列说法正确的是![]()
A.AD盐溶液![]()
B.酸的电离程度一定是![]()
C.碱的电离程度一定是![]()
D.在AC盐溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铜及其化合物在日常生产、生活中有着广泛的应用。请回答下列问题:
(1)铁在元素周期表中的位置是____,基态铁原子的核外电子排布式为_________。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于________晶体(填晶体类型)。CO2在高温高压下所形成的晶体其晶胞如下图所示。则该晶体的类型属于_________晶体(填晶体类型)。
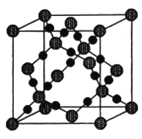
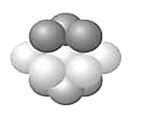
(3)铜晶体中铜原子的堆积方式如下图所示。其中铜原子的配位数为_______。
(4)CuCl2和CuCl是铜的两种常见的氯化物。
①下图表示的是________(填“CuCl2”或“CuCl”)的晶胞。
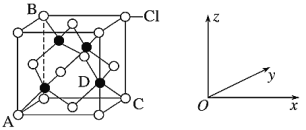
②原子坐标参数表示晶胞内部各原子的相对位置。上图中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,1,0);则D原子的坐标参数为_______。
③图示晶胞中C、D两原子核间距为298pm,阿伏加德罗常数的值为NA,则该晶体密度为_____g·cm-3。(列出计算式即可)相对原子质量:Cu 64 Cl 35.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G元素原子序数依次增大。已知B原子最外层有3个未成对电子,C原子最外层电子数与核外电子总数之比为3:4,E与C同主族,F-、D+、A+离子的半径逐渐减小,化合物AF常温下为气体,G的基态原子核外M能层填满电子,N能层只有1个电子。
据此回答下列问题:
(1)写出D元素基态原子的核外电子排布式____________;B、C、E三种元素的第一电离能由大到小的顺序是(用元素符号表示)_____________________
(2)A与C可形成1 8电子分子,其水溶液中滴人少量氯化铁溶液时有大量气泡逸出,写出该反应的化学方程式_______________________________________
(3)某化合物由上述七种元素中的三种元素组成,为常见家用消毒剂的主要成分,其中化学键类型为______________;该化合物水溶液不呈中性的原因是(用离子方程式表示)________________________。
(4)0.3molG的低价氧化物能与____________molB的最高价氧化物对应水化物的溶液恰好完全反应(设还原产物只有BO)。
(5)卫星零射时可用B2A4为燃料,l mol气态B2A4在适量C2中燃烧,生成B2和气态A2C,放出534 kJ的热量,l mol液态A2C完全气化需吸收44 kJ热量。请写出气态B2A4在C2中燃烧生成B2和液态A2C时的热化学方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.H2的热值(单位质量的燃料完全燃烧时所放出的热量,叫做燃料的热值)为142.9kJg-1,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l) △H=-285.8kJmol-1
B.反应A(g)=2B(g),若正反应的活化能为EakJmol-1,逆反应的活化能为EbkJmol-1,则△H=(Ea-Eb)kJmol-1
C.能自发进行的化学反应,一定是△H<0、△S>0
D.增大反应物浓度,可增大单位体积内活化分子百分数,从而增加有效碰撞的次数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com