
【题目】从实验测得不同物质中氧—氧之间的键长和键能的数据如下表:
O—O键 数据 | O | O | O2 | O |
键长/10-12m | 149 | 128 | 121 | 112 |
键能/kJ·mol-1 | x | y | z=494 | w=628 |
其中x、y的键能数据尚未测定,但可根据规律性推导键能的大小顺序为w>z>y>x。该规律性是( )
A. 成键时电子数越多,键能越大 B. 键长越短,键能越大
C. 成键所用的电子数越少,键能越小 D. 成键时电子对越偏移,键能越大
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】近期发现,H2S是继NO、CO之后第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为________________、______________,制得等量H2所需能量较少的是_____________(填“系统(Ⅰ)”或“系统(Ⅱ)”)。
(2)羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g) +H2O(g)。在610 k时,将1 mol CO2与1 mol H2S充入2 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g) +H2O(g)。在610 k时,将1 mol CO2与1 mol H2S充入2 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率![]() =_______%,反应平衡常数K=________。
=_______%,反应平衡常数K=________。
②在620 K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率![]() _____
_____![]() ,该反应的
,该反应的![]() H_____0。(填“>”“<”或“=”)
H_____0。(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是________(填标号)
A.N2 B.H2S C.COS D.CO2
(3)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如右图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c( H2S ) + c( HS- )=_____mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=______时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13 ]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液只可能含有K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-中的若干种离子。某同学取100 mL的溶液分成两等份进行如下实验:
①第一份加过量的氢氧化钠溶液后加热,收集到0.05 mol有刺激性气味的气体,同时得到澄清溶液甲。
②向溶液甲中通入过量的二氧化碳气体,生成白色沉淀,沉淀经过滤,洗涤灼烧后,得到1.02 g固体。
③第二份加足量的氯化钡溶液后,生成白色沉淀,加入足量盐酸,沉淀并不溶解,过滤沉淀,充分洗涤,干燥,得到11.65 g固体。
(1)在原溶液中一定存在的离子有_________________________________;一定不存在的离子有_____________________;不能确定是否存在的离子有___________。
(2)为了确定不能确定的离子是否存在,可以采取的方法为__________________________________。
(3)由操作②确定的离子在溶液中的浓度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置进行相关实验,操作正确且能达到实验目的的是
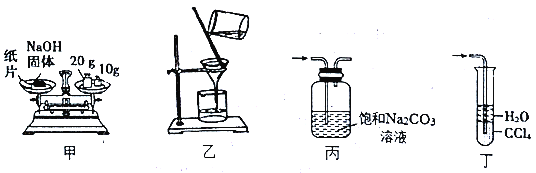
A. 甲装置:称30.0gNaOH固体 B. 乙装置:过滤除去溶液中的不溶性杂质
C. 丙装置:除去CO2中混有的HCl气体 D. 丁装置:吸收实验室制NH3的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电导率越大导电能力越强。常温下用0.100 mol·L-1NaOH溶液分别滴定10.00mL浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线①代表滴定盐酸的曲线
B. 滴定醋酸的过程应该选择甲基橙作为指示剂
C. a、b、c三点溶液中水的电离程度:c>a>b
D. b点溶液中:c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量铜与100mLcmol/L的稀硝酸反应,产生1.12LNO(标准状况),反应结束后,向反应后的溶液中滴加1.0mol/L的NaOH溶液,滴加过程中,产生沉淀的质量与加入NaOH 溶液的体积关系如下图所示。
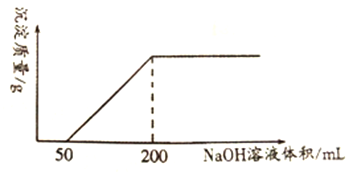
回答下列问题:
(1)写出铜与稀硝酸反应的离子方程式_____________________________________________。
(2)铜与稀硝酸反应中被还原HNO3的物质的量为________mol。
(3)铜与稀硝酸反应后的溶液中,H+的物质的量浓度为________mol/L(反应前后溶液体积变化忽略不计)。
(4)稀硝酸的物质的量浓度c=______mol/L。
(5)将铜与稀硝酸反应生成的NO通入NaOH 溶液中,并加入20%的H2O2水溶液使其全部转化为NaNO3,反应的化学方程式是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】速力菲的主要成分是琥珀酸亚铁,是一种常见的补铁药物。某同学为检测速力菲中Fe2+的存在,设计并进行实验如下:
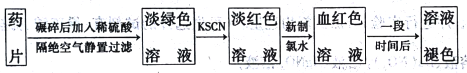
回答下列问题:
(1)实验中碾碎药片需要的仪器是____________。
(2)加KSCN溶液后,溶液呈淡红色,其原因可能是___________。加入新制氯水后,发生反应的离子方程式为_________________。
(3)放置一段时间后,溶液的颜色会逐渐褪去。请对溶液褪色的原因作出2种猜想:
编号 | 猜想 |
甲 | ______ |
乙 | _______ |
(4)医学上服用维生素C,可防止二价亚铁离子被氧化,由此推测维生素C具有______性。
(5)正常人每天应补充14mg左右的铁,其中绝大部分来自于食物。如果全部通过服用含FeS04·7H2O的片剂来补充铁,则正常人每天需服用含_____mgFeSO4·7H2O的片剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是地球上组成生命的最基本的元素之一。根据要求回答下列问题:
(1)碳原子的价电子排布图:_________,核外有_________种不同运动状态的电子。
(2)碳可以形成多种有机化合物,下图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。
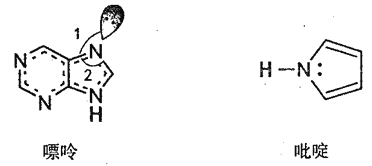
①嘌呤中所有元素的电负性由大到小的顺序__________。
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因_____________。
③吡啶结构中N 原子的杂化方式___________。
④分子中的大π键可以用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() )。该嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为__________。
)。该嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为__________。
(3)碳可形成CO、CO2、H2CO3等多种无机化合物。
①在反应CO 转化成CO2 的过程中,下列说法正确的是______。
A.每个分子中孤对电子数不变 B.分子极性变化
C.原子间成键方式改变 D.分子的熔沸点变大
②干冰和冰是两种常见的分子晶体,晶体中的空间利用率: 干冰___冰。(填“>”、 “<”或“=”)
③H2CO3与H3PO4 均有1个非羟基氧,H3PO4为中强酸,H2CO3为弱酸的原因______。
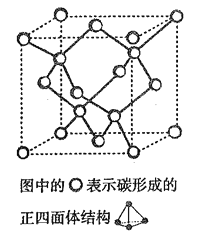
(4)在2017 年,中外科学家团队共同合成了碳的一种新型同素异形体: T- 碳。T- 碳的结构是: 将立方金刚石中的每个碳原子用一个由4 个碳原子组成的正四面体结构单元取代,形成碳的一种新型三维立方晶体结构,如下图。已知T- 碳晶胞参数为a pm,阿伏伽德罗常数为NA,则T- 碳的密度的表达式为______g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com