
【题目】镓(31Ga)、锗(32Ge)都是重要的稀有金属,在化学催化剂、半导体材料、新能源等领域应用广泛,可从锗煤燃烧后的粉煤灰(含 Ga2O3、GeO2、SiO2、Al2O3)中提取, 部分流程如下:

已知:
物质 | GaCl3 | GeCl4 | AlCl3 |
沸点/℃ | 201 | 84 | 183(升华) |
(1)滤渣的主要成分为_____。
(2)①中发生的反应有 Al2O3+6H+=2Al3++3H2O、Ga2O3+6H+=2Ga3++3H2O 和_____。
(3)操作 a 的名称是_____,②中控制温度的范围是_____(填字母序号)。
a.20~84℃ b.84~183℃ c.84~201℃
(4)④中发生反应的化学方程式是__________________________________________。
(5)镓能与沸水剧烈反应生成氢气,锗在加热条件下与盐酸或稀硫酸不反应。从原子结构角度解释其原因:______________________
(6)用浓盐酸酸化的磷酸三丁酯(TBP)可以从残液中萃取 Ga3+,相关反应为:TBP+GaCl3+HCl![]() TBPH+·GaCl
TBPH+·GaCl![]() 。用稀 NaOH 溶液对有机相进行反萃取,用盐酸调节反萃取液 pH 至 5~6,然后升温至 85~95℃水解得到 Ga(OH)3,经后续处理得到粗镓。结合化学用语解释用稀 NaOH 溶液对有机相进行反萃取的原因:_________________。
。用稀 NaOH 溶液对有机相进行反萃取,用盐酸调节反萃取液 pH 至 5~6,然后升温至 85~95℃水解得到 Ga(OH)3,经后续处理得到粗镓。结合化学用语解释用稀 NaOH 溶液对有机相进行反萃取的原因:_________________。
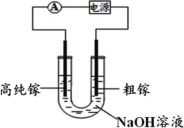
(7)电解法可以提纯粗镓,具体原理如图所示。镓在阳极溶解生成的 Ga3+与 NaOH 溶液反应生成 GaO![]() ,GaO
,GaO![]() 在阴极放电的电极反应式是_____________________。
在阴极放电的电极反应式是_____________________。
【答案】SiO2 GeO2+4H++4Cl-=GaCl4+2H2O 蒸馏 b GeO2+2H2![]() Ge+2H2O 镓和锗均为第4周期的主族元素,镓的最外层电子数为3,锗的最外层电子数为4,故镓的金属性较强,锗的金属性较弱 当向有机层加入用稀 NaOH 溶液,NaOH可以与HCl发生中和反应,从而使化学平衡TBP+GaCl3+HCl
Ge+2H2O 镓和锗均为第4周期的主族元素,镓的最外层电子数为3,锗的最外层电子数为4,故镓的金属性较强,锗的金属性较弱 当向有机层加入用稀 NaOH 溶液,NaOH可以与HCl发生中和反应,从而使化学平衡TBP+GaCl3+HCl![]() TBPH+·GaCl
TBPH+·GaCl![]() 向逆反应方向移动,故可对有机相进行反萃取 GaO
向逆反应方向移动,故可对有机相进行反萃取 GaO![]() +3e- +2H2O=Ga+4OH-
+3e- +2H2O=Ga+4OH-
【解析】
由流程可知,粉煤灰经浓盐酸浸取,过滤后的滤液中经蒸馏,分离出四氯化锗,将四氯化锗与水混合搅拌24h,可以发生水解得到GeO2,最后GeO2被氢气还原为Ge。
(1)粉煤灰中的SiO2不与盐酸反应,所以,滤渣的主要成分为SiO2。
(2)由题中信息可知,Ga2O3、GeO2、Al2O3皆可溶于盐酸,所以,①中发生的反应有Al2O3+6H+=2Al3++3H2O、Ga2O3+6H+=2Ga3++3H2O和GeO2+4H++4Cl-=GaCl4+2H2O。
(3)由题中信息可知,四氯化锗的沸点较低,操作 a 需要控制温度,故其为蒸馏,蒸馏时要防止氯化镓和氯化铝气化,故②中控制温度的范围是84~183℃ ,答案选b。
(4)④中GeO2被氢气还原为Ge,发生反应的化学方程式是GeO2+2H2![]() Ge+2H2O。
Ge+2H2O。
(5)镓能与沸水剧烈反应生成氢气,锗在加热条件下与盐酸或稀硫酸不反应。从原子结构角度解释其原因:镓和锗均为第4周期的主族元素,镓的最外层电子数为3,锗的最外层电子数为4,故镓的金属性较强,锗的金属性较弱。
(6)用浓盐酸酸化的磷酸三丁酯(TBP)可以从残液中萃取Ga3+,相关反应为:TBP+GaCl3+HCl![]() TBPH+·GaCl
TBPH+·GaCl![]() 。根据平衡移动原理可知,当向有机层加入用稀 NaOH 溶液,NaOH可以与HCl发生中和反应,从而使化学平衡TBP+GaCl3+HCl
。根据平衡移动原理可知,当向有机层加入用稀 NaOH 溶液,NaOH可以与HCl发生中和反应,从而使化学平衡TBP+GaCl3+HCl![]() TBPH+·GaCl
TBPH+·GaCl![]() 向逆反应方向移动,故可对有机相进行反萃取。
向逆反应方向移动,故可对有机相进行反萃取。
(7)电解法可以提纯粗镓,镓在阳极溶解生成的Ga3+与 NaOH 溶液反应生成 GaO![]() ,GaO
,GaO![]() 在阴极放电生成Ga,其电极反应式是GaO
在阴极放电生成Ga,其电极反应式是GaO![]() +3e-+2H2O=Ga+4OH-。
+3e-+2H2O=Ga+4OH-。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在常温常压下,24mLH2S和O2的混合气体点燃后,生成6mLSO2,则原混合气体中H2S的体积可能为
A. 10mLB. 12mLC. 16mLD. 18mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成一种熔合物,根据下列四种金属的熔沸点,其中不能形成合金的是
Na | Cu | Al | Fe | |
熔点/ | 97.5 | 1083 | 660 | 1535 |
沸点/ | 883 | 2595 | 2200 | 3000 |
A.Cu和AlB.Fe和CuC.Fe和NaD.A1和Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如下图所示:
(1)A中制取C12反应的化学方程式是_____________________________。
(2)D装置中的石棉上吸附着潮湿的KI粉末,其作用是_________________________。
(3)E装置的作用是______________(填序号)。
A.收集气体B.吸收氯气C.吸收氯化氢
(4)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是______________。
(5)将lmolCH4与C12发生取代,测得4种有机取代物的物质的量相等,则消耗的氯气的物质的量是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为①4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2,②2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O,下列说法正确的是 ( )
8Na2CrO4+2Fe2O3+8CO2,②2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O,下列说法正确的是 ( )
A. 反应①和②均为氧化还原反应
B. 反应①的氧化剂是O2,还原剂是FeO·Cr2O3
C. 高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4
D. 反应①中每生成1 mol Na2CrO4时转移电子3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A.由反应:M(s)+N(g) ![]() R(g) △H1 ,M(g)+N(g)
R(g) △H1 ,M(g)+N(g) ![]() R(g) △H2,得出△H 2>△H 1
R(g) △H2,得出△H 2>△H 1
B.已知:2SO2(g)+O2(g) ![]() 2SO3(g);△H=-98.3kJ/mol。将1molSO2和0.5molO2充入一密闭容器中反应,放出49.15kJ的热量
2SO3(g);△H=-98.3kJ/mol。将1molSO2和0.5molO2充入一密闭容器中反应,放出49.15kJ的热量
C.电解精炼铜时,电源负极与纯铜相连,且电解质溶液浓度始终保持不变
D.用惰性电极电解 Na2SO4溶液,当阴极产生1mol气体时,可加18 g 水使溶液恢复
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的密闭容器中,不能说明可逆反应H2(g)+I2(g)![]() 2HI(g)已经达到平衡的标志是( )
2HI(g)已经达到平衡的标志是( )
A.HI的生成速率与HI的分解速率相等
B.HI的生成速率与H2的生成速率之比是2∶1
C.单位时间内一个H-H键断裂的同时有两个H-I键断裂
D.单位时间里断裂2nmolHI的同时生成nmolI2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图实验装置验证通过改变浓度来实现反应,2Fe3++2I-=2Fe2++I2中Fe3+与Fe2+的相互转化。K 闭合时,电流表指针第一次发生偏转,当指针归零后,向左管滴油加0.01mol/L的AgNO3溶液,发现指针第二次偏转,方向相反。下列有关说法不正确的是( )

A. 指针第一次偏转时,b极反应式为Fe3++e-=Fe2+
B. 加入AgNO3后,a为正极
C. 当b极有0.001molFe3+被还原时,则通过盐桥的电子数为0.001NA
D. 第二次指针偏转的原因是:I-浓度减小,反应逆向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
(1)若电解食盐水时消耗NaCl的质量为234 g,则在理论上最多可得氯气的体积为________升(标准状况)。
(2)若将2 mol的氯气通入足量石灰乳中,理论上可得到次氯酸钙________克。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com