
【题目】下图是一种微生物燃料电池的工作原理示意图,工作过程中必须对某室进行严格密封。下列有关说法错误的是
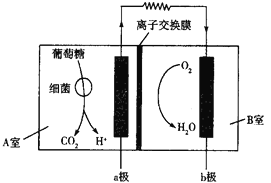
A.a极的电极反应式为![]()
B.若所用离子交换膜为质子交换膜,则![]() 将由A室移向B室
将由A室移向B室
C.根据图示,该电池也可以在碱性环境中工作
D.由于A室内存在细菌,所以对A室必须严格密封,以确保厌氧环境
【答案】C
【解析】
本题考查电化学原理,意在考查对电解池原理的理解和运用能力。
A.由图可知负极(a极)反应式为C6H12O6+6H2O-24e-=6CO2↑+24H+,正极(b极)反应式为O2+4H++4e-=2H2O,故不选A;
B.根据图示和题中信息,A室产生![]() 而B室消耗
而B室消耗![]() ,氢离子将由负极移向正极,故不选B;
,氢离子将由负极移向正极,故不选B;
C.在负极室厌氧环境下,有机物在微生物作用下分解并释放出电子和质子,电子依靠合适的电子传递介体在生物组分和负极之间进行有效传递,并通过外电路传递到正极形成电流,而质子通过质子交换膜传递到正极,氧化剂(一般为氧气)在正极得到电子被还原与质子结合成水,所以不可以碱性环境,故选C;
D.由于A室内存在细菌,所以对A室必须严格密封,以确保厌氧环境,故不选D;
答案:C


科目:高中化学 来源: 题型:
【题目】NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2 析出,依据I2 析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1的NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝的时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是
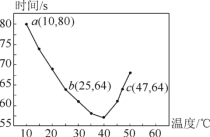
A. 40℃之前与40℃之后溶液变蓝时间随温度的变化趋势相反
B. 图中b、c两点对应的NaHSO3的平均反应速率一定相等
C. 图中a点对应的NaHSO3的平均反应速率为5.0×10-5mol·L-1·s-1
D. 温度高于40℃时,淀粉不宜用作该实验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铵简称硝铵,可用作化肥,含氮量高。它在发生某些反应时既放出大量热又生成大量气体而爆炸,也可作炸药使用。
(1)硝铵受热:NH4NO3→N2O↑+2H2O,该反应中因为有____而属于氧化还原反应,其中发生还原过程元素的变化为___。
(2)硝铵受撞击:2NH4NO3→O2+2N2+4H2O,请在该反应方程式上补齐电子转移的方向和数目___。若反应中转移电子数为3.01×1024,则反应产生的气体在标准状况下的体积为____。
(3)一定温度下,硝铵分解:___NH4NO3→___HNO3+___N2↑+___H2O,配平该反应方程式,把系数填入对应的位置上。反应中被氧化与被还原的原子的物质的量之差为5mol时,参加反应的硝铵的质量为___。
(4)硝铵易溶于水,溶解时溶液的温度降低。硝铵溶于水时,温度降低的原因是_____,该水溶液呈(填“酸”“碱”或“中”)____性,用离子方程式表示原因为_____。
(5)为使该水溶液在常温下的pH为7,并不引入杂质,可以_____,试证明所得的溶液中c(NH4+)=c(NO3-):_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在5L的密闭容器中进行下述反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) 30s内,NO增加了0.3mol,则在30s内,该反应的平均反应速率正确的是
4NO(g)+6H2O(g) 30s内,NO增加了0.3mol,则在30s内,该反应的平均反应速率正确的是
A.V(O2 )=0.01mol·L-1·s-1 B.V(NO )=0.08mol·L-1·s-1
C.V(H2O)=0.01mol·L-1·s-1 D.V(NH3)=0.002mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烯雌酚是一种激素类药物,结构如图所示,下列叙述正确的是( )
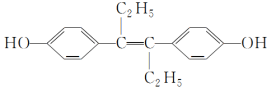
A. 1 mol己烯雌酚完全燃烧能生成18 mol CO2和12 mol H2O
B. 1 mol己烯雌酚可与5 mol Br2发生取代反应
C. 己烯雌酚苯环上的一氯取代物有2种(不包括顺反异构)
D. 己烯雌酚分子结构中至少有16个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应)。请回答下列问题:
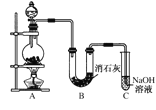
(1)A为实验室制氯气的发生装置,反应化学方程式为_________________________;某学生用12 mol·L-1的浓盐酸100 mL和足量的MnO2反应制Cl2,实际得到的Cl2________6.72 L(填“<”、“>”或“=”)。
(2)漂白粉将在U形管中产生,其化学方程式是_________________________________。
(3)此实验所得漂白粉的有效成分偏低。该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是________________。
②Cl2中含HCl,会发生反应2HCl+Ca(OH)2===CaCl2+2H2O,为避免此副反应的发生,可将装置作何改进______________________________。
(4) C装置的作用是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于元素周期表中下列位置的①~⑩十种元素,请回答有关问题(用元素符号或化学式回答)。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
(1)在上述元素中,金属性最强的是___,原子半径最大的是___(0族除外)。
(2)用电子式表示⑦和⑩形成的化合物的过程___。
(3)表中元素构成10电子微粒的分子有:___(任写2种)。
(4)⑤和⑨分别与氢原子构成的简单氢化物中沸点最高的是___。
(5)表中元素⑤和⑦可以形成一种淡黄色物质X,写出X的电子式:___,该物质所含化学键类型___,0.1molX与水反应转移电子数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下列8组物质或粒子:
①14N和14C
②16O和18O
③氰酸铵(NH4CNO)与尿素[CO(NH2)2]
④足球烯(C60)和金刚石
⑤CH3CH2CH2CH3和CH(CH3)3
⑥CH3CH2CH3和CH3(CH2)2CH3
⑦![]() 和
和![]()
⑧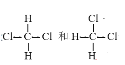
(1)互为同素异形体的是____________(填编号,下同),
(2)互为同位素的是____________,
(3)互为同系物的是____________,
(4)互为同分异构体的是____________。
Ⅱ.回答下列有关有机化学的问题:
(5)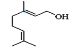 的分子式为____________,该物质所含官能团名称是____________。
的分子式为____________,该物质所含官能团名称是____________。
(6)苯与浓硫酸和浓硝酸混合加热产生硝基苯的反应方程式为____________,反应类型是____________。
(7)下列能使酸性高锰酸钾溶液褪色的是____________。
A.乙醇 B.聚乙烯 C.苯 D.甲苯 E.戊烷 F.苯乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】少量铁粉与![]() 的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变
的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变![]() 的产量,可以使用如下方法中的( )
的产量,可以使用如下方法中的( )
①加水②加![]() 固体③滴入几滴浓盐酸④加
固体③滴入几滴浓盐酸④加![]() 固体⑤加
固体⑤加![]() 溶液⑥滴入几滴硫酸铜溶液⑦适当升高温度(不考虑盐酸挥发)
溶液⑥滴入几滴硫酸铜溶液⑦适当升高温度(不考虑盐酸挥发)
A.①⑥⑦B.③⑦C.③⑤D.⑤⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com