


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
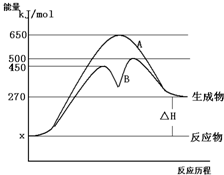 反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
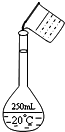 实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:
实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用滴管滴加液体时滴管应垂直悬垂在容器上方且不能触及容器内壁 |
| B、手持试管给试管内的物质加热 |
| C、用燃着的酒精灯去点燃另一盏酒精灯 |
| D、用天平称量药品时用手直接拿砝码 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com