
【题目】下列事实,不能用勒夏特列原理解释的是( )
A.溴水中有平衡:Br2+H2O![]() HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅
HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅
B.对CO(g) + NO2 (g)![]() CO2(g)+ NO(g) 平衡体系增大压强可使颜色变深
CO2(g)+ NO(g) 平衡体系增大压强可使颜色变深
C.高压比常压有利于合成SO3的反应
D.合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g) ![]() 2C(g),达到平衡后,在不同的时间段内反应物的浓度随时间的变化如图甲所示,正逆反应速率随时间的变化如图乙所示,下列说法中正确的是( )
2C(g),达到平衡后,在不同的时间段内反应物的浓度随时间的变化如图甲所示,正逆反应速率随时间的变化如图乙所示,下列说法中正确的是( )

A.30~40 min间该反应使用了催化剂
B.化学方程式中的x=1,正反应为吸热反应
C.30 min时降低温度,40 min时升高温度
D.8 min前A的平均反应速率为0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿![]() 是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
![]() 冶炼铜的反应为
冶炼铜的反应为 若
若![]() 中Fe的化合价为
中Fe的化合价为![]() ,反应中被还原的元素是______
,反应中被还原的元素是______![]() 填元素符号
填元素符号![]() .
.
![]() 冶炼铜的主要流程如图:
冶炼铜的主要流程如图:

![]() 气体A中的大气污染物可选用下列试剂中的______吸收.
气体A中的大气污染物可选用下列试剂中的______吸收.
![]() 浓
浓![]()
![]() 稀
稀![]()
![]() 溶液
溶液
![]() 用稀
用稀![]() 浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,一位同学由此得出该熔渣中铁元素价态为
浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,一位同学由此得出该熔渣中铁元素价态为![]() 的结论.请指出该结论是否合理并说明理由______.
的结论.请指出该结论是否合理并说明理由______.
![]() 冶炼出的铜可以发生下列反应
冶炼出的铜可以发生下列反应![]() 图
图![]()
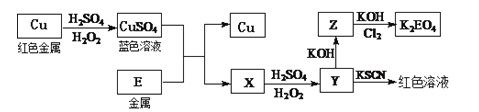
![]() 写出Cu溶于稀
写出Cu溶于稀![]() 和
和![]() 混合液的离子方程式:______.
混合液的离子方程式:______.
![]() 写出
写出![]() 将Z氧化为
将Z氧化为![]() 的化学方程式:______.
的化学方程式:______.
![]() 对于
对于![]()
![]() 溶液,正确的是______.
溶液,正确的是______.
A、常温下,![]()
B、![]()
C、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是实验室制取SO2并验证SO2的某些性质的装置图。试回答:
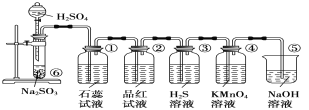
(1)①中的实验现象为石蕊试液___,此实验证明SO2是______气体。
(2)②中的品红溶液__________,证明SO2有________。
(3)③中的实验现象是____________,证明SO2有______性。
(4)④中的实验现象是____________,证明SO2有______性。
(5)⑤的作用是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常用图象直观地描述化学反应的进程或结果(图④纵坐标表示难溶物达到饱和时的浓度)。下列对图象描述正确的是

A.根据图①可判断可逆反应A2(g) +3B2(g)![]() 2AB3(g)的△H>0
2AB3(g)的△H>0
B.图②可表示压强对可逆反应2A(g) +2B(g)![]() 3C (g) + D(s)的影响,乙的压强大
3C (g) + D(s)的影响,乙的压强大
C.图③可表示向乙酸溶液中通入氨气至过量的过程中溶液导电性的变化
D.根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白:
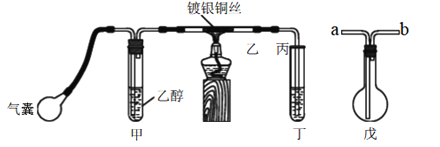
(1)甲装置常常浸在70~80℃的水浴中,目的是____________________。
(2)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。乙醇的催化氧化反应是________反应(填“放热”或“吸热”),该反应的化学方程式为______________。
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接_______、_______接丙;若产物不用水吸收而是直接冷却,应将试管丁浸在___________中。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下图装置进行实验,并回答下列问题:

(1)判断装置的名称:A池为___________ ;B池为______________;
(2)锌极为________极,电极反应式为___________________________________;铜极为________极,电极反应式为___________________________________;石墨棒C1为______极,电极反应式为__________________________________;石墨棒C2附近发生的实验现象为______________________________________;
(3)当C2极析出224mL气体(标准状态)时,锌的质量变化_________(变大、不变或变小)了________g,CuSO4溶液的质量_________(增加、不变或减少)_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性![]() 溶液与
溶液与![]() 溶液反应的离子方程式为:
溶液反应的离子方程式为:![]() ,某同学设计如下表所示方案探究温度、浓度改变对该反应速率的影响情况。
,某同学设计如下表所示方案探究温度、浓度改变对该反应速率的影响情况。
实验序号 | 实验温度 | 参加反应的物质 | 溶液颜色褪至无色所需时间 | ||||
|
|
| |||||
|
|
|
|
| |||
A | 298 | 2 |
| 4 | a | 0 |
|
B |
| 2 |
| 3 | a |
| 10 |
C | 318 | 2 |
|
| a | 1 |
|
(1)实验中a的最小值为____________,探究温度变化对反应速率影响情况的两组实验是________。
(2)![]() ____________,
____________,![]() ____________,利用实验B中数据计算,用
____________,利用实验B中数据计算,用![]() 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为![]() ________。
________。
(3)他们发现,A组实验中收集的![]() 体积如图a所示;若使A组反应在绝热容器中进行,该反应的反应速率随着时间的变化如图b所示。
体积如图a所示;若使A组反应在绝热容器中进行,该反应的反应速率随着时间的变化如图b所示。
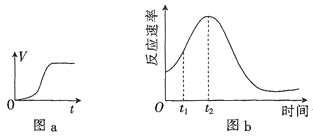
![]() 时间内速率变快的主要原因可能是:一是产物中
时间内速率变快的主要原因可能是:一是产物中![]() 是反应的催化剂;二是______________________________。
是反应的催化剂;二是______________________________。
![]() 由图b信息知,催化剂的催化效果与其用量________
由图b信息知,催化剂的催化效果与其用量________![]() 填“有关”“无关”或“无法确定”
填“有关”“无关”或“无法确定”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是
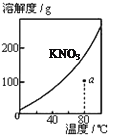
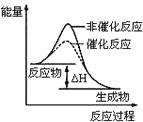

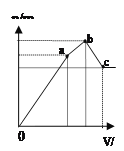
图1 图2 图3 图4
A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示反应aA(g)+bB(g)![]()
![]() cC(g)表示改变某一条件对化学平衡的影响, 若p1>p2此反应自发进行,必须满足的条件是低温
cC(g)表示改变某一条件对化学平衡的影响, 若p1>p2此反应自发进行,必须满足的条件是低温
D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com