
【题目】按下图装置进行实验,并回答下列问题:

(1)判断装置的名称:A池为___________ ;B池为______________;
(2)锌极为________极,电极反应式为___________________________________;铜极为________极,电极反应式为___________________________________;石墨棒C1为______极,电极反应式为__________________________________;石墨棒C2附近发生的实验现象为______________________________________;
(3)当C2极析出224mL气体(标准状态)时,锌的质量变化_________(变大、不变或变小)了________g,CuSO4溶液的质量_________(增加、不变或减少)_________g。
【答案】原电池 电解池 负极 Zn—2e-=Zn2+ 正极 Cu2++2e-=Cu 阳极 2Cl--2e-=Cl2↑ 溶液呈红色 变小 0.65 增加 0.01
【解析】
(1)由题给装置可知,A为原电池,B为电解池;
(2)A为原电池,金属活泼性较强的锌为负极,电极反应式为Zn-2e-=Zn2+;金属活泼性较弱的铜为正极,电极反应为:Cu2++2e-=Cu,石墨棒C1与原电池的正极相连为电解池的阳极,阳极上氯离子失电子生成氯气,电极反应式为:2Cl--2e-=Cl2↑;石墨棒C2与原电池的负极相连为电解池的阴极,电极反应式为2H++2e-=H2↑,阴极附近生成氢气和氢氧根离子,溶液呈变红;
(3)石墨棒C2与原电池的负极相连为电解池的阴极,电极反应式为2H++2e-=H2↑,当C2极析出224mL气体(标准状况)时,生成氢气的物质的量为0.01mol,转移的电子为0.02mol,锌电极的方程式为:Zn-2e-=Zn2+,根据电子守恒可知,消耗的Zn为0.01mol,则锌的质量减少0.65g,生成铜的物质的量为0.01mol,质量为6.4g,硫酸铜溶液质量增加0.01g。


科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作①的名称是________,操作②的名称是____________。
(2)试剂a是____________(填化学式,下同),试剂b是__________,固体B是____________。
(3)加入试剂a所发生反应的化学方程式为__________________________________。
加入试剂b所发生反应的化学方程式为____________________________________。
(4)该方案能否达到实验目的:__________________________(填“能”或“不能”)。若不能,应如何改进?(若能,此问不用回答)__________。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是____的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色。试完成以下问题:

(1)电源A极的名称是________。
(2)甲装置中电解反应的总化学方程式是____________。
(3)如果收集乙装置中产生的气体,两种气体的体积比是________。
(4)欲用丙装置给铜镀银,G应该是________(填“铜”或“银”),电镀液的主要成分是________(填化学式) 。
(5)装置丁的现象是________,说明________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性ZnO在橡胶、塑料、涂料工业有重要应用,工业上用含锌物料(含FeO、CuO等杂质)制取活性ZnO的流程如图所示:

(1)上述流程中,浸出时用的是60% H2SO4(密度是1.5 g/cm3),则该H2SO4的物质的量浓度为______________ (保留两位小数) 。
(2)上述流程H2SO4浸出后溶液中Fe3+的浓度为0.04 mol·L-1,控制滤液的pH,加入H2O2后产生大量红褐色沉淀。
①粗略测定溶液pH的实验操作是___________________________________________。
②已知:常温下Fe(OH)3的Ksp=4.0×10-38。滤液的pH至少为________时,溶液中Fe3+开始沉淀。
(3)A溶液中主要含有的溶质是______________,验证溶质所含阳离子的方法是_____________。
(4)制备ZnO所焙烧的物质是含结晶水的碱式碳酸锌。取碱式碳酸锌6.82g,溶于HCl生成CO2 448 mL(标准状况下),溶解过程消耗HCl 0.12mol,若该碱式盐中氢元素的质量分数为1.76%,试推测该碱式碳酸锌的化学式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的![]() 及泥沙,可将粗盐溶于水,然后进行下列五项操作。正确的操作顺序是( )
及泥沙,可将粗盐溶于水,然后进行下列五项操作。正确的操作顺序是( )
①过滤 ②加过量![]() 溶液 ③加过量盐酸
溶液 ③加过量盐酸
④加热煮沸 ⑤加过量的![]() 溶液 ⑥过量
溶液 ⑥过量![]() 溶液。
溶液。
A.②⑤⑥①③④B.⑤②⑥③①④C.⑥②⑤③④①D.⑥②①⑤③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲测定室温下(25℃,101kPa)的气体摩尔体积,请回答以下问题。该小组设计的简易实验装置如图所示:

该实验的主要操作步骤如下:
①配制 100 mL 1.0mol/L的盐酸溶液:.
②用_______________(填仪器名称并注明规格)量取7.5mL 1.0mol/L的盐酸溶液加入锥形瓶中;
③称取ag已除去表面氧化膜的镁条,并系于铜丝未端,为使HCl全部参加反应,a的数值至少为__________;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,忽略导管中的水,读出量筒中水的体积为91.9mL
请将上述步骤补充完整并回答下列问题。
(1)步骤①中所需要带刻度的仪器为__________,若用36.5%的浓盐酸(密度为1.20g/mL)
进行稀释配制,则需要量取该浓盐酸___________mL
(2)步骤①中,配制100 mL 1.0mol/L的盐酸溶液时,下列哪些操作会使配制浓度偏低___________(填写字母).
A.用量筒量取浓盐酸时,俯视量筒的刻度
B.容量瓶未干燥即用来配制溶液.
C.未洗涤烧杯和玻璃棒
D.定容完成后,将容量瓶倒置摇匀后;发现液面低于刻度线
E.在容量瓶中定容时俯视容量瓶刻度线.
F.烧杯中有少量水.
(3)请填写操作步骤中的空格:步骤②_________步骤③_______________
(4)实验步骤5中应选用______________(填字母)的量筒。.'
A.100 mL B.200mL C.500mL
(5)忽略水蒸气影响,在该条件下测得气体摩尔体积为Vm=_____________L/mol(保留2位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学教师为“氯气与金属钠反应”设计了如图装置的实验。实验操作:先给钠预热,等钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述中错误的是
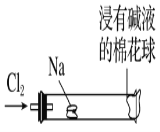
A.反应生成的大量白烟是氯化钠晶体
B.玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气
C.钠着火产生黄色火焰,自然界中存在游离态钠
D.若在棉花球外沿滴一滴石蕊溶液,据其颜色变化判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)甲醇是一种重要的化工原料,有着重要的用途和应用前景。工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)CH3OH(g);△H1
反应II:CO2(g)+3H2(g)CH3OH(g)+H2O(g);△H2
①上述反应中原子利用率百分之百的是______(填“I”或“Ⅱ”)
②下表所列数据是反应I在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断△H1______0,T℃时,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,此时T为______。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合金只含铝、铁、铜三种元素,取合金![]() ,加入到含
,加入到含![]() 稀硝酸的溶液中,恰好完全反应,放出无色气体11.2L(标准状况下)。将反应后的溶液分成2等份,向一份溶液中滴加
稀硝酸的溶液中,恰好完全反应,放出无色气体11.2L(标准状况下)。将反应后的溶液分成2等份,向一份溶液中滴加![]() ,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体cg,减轻了5.4g,再加入到过量的
,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体cg,减轻了5.4g,再加入到过量的![]() 溶液中,剩余不溶物dg。下列说法不正确的是
溶液中,剩余不溶物dg。下列说法不正确的是
已知;![]() 遇到
遇到![]() 会出现蓝色沉淀。
会出现蓝色沉淀。
A. ![]()
B. 原合金中铜的质量为![]()
C. 若将上述![]() 稀硝酸逐滴加入到合金中,放出气体仍为
稀硝酸逐滴加入到合金中,放出气体仍为![]() (标准状况下)
(标准状况下)
D. d不是一确定值,可能为8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com