
【题目】I.《自然》杂志曾报道我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”。完成下列填空:
(1)l0Be和9Be_____________(填序号)。
a.是同一种原子 b.具有相同的中子数 c.具有相同的化学性质 d.互为同位素
(2)写出A1(OH)3与NaOH溶液反应的化学方程式:_________________________。
(3)研究表明28A1可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是____________(填序号)。
a.比较Mg(OH)2与A1(OH)3的碱性强弱
b.比较这两种元素的最高正化合价
c.将打磨过表面积相同的镁条和铝片分别和100℃热水作用,并滴入酚酞溶液
d.比较这两种金属的硬度和熔点
II.下表列出了①~⑩10种元素在周期表中的位置。
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑤ | ⑥ | ⑩ | |||||
3 | ① | ③ | ④ | ⑦ | ⑧ | |||
4 | ② | ⑨ |
(1)上述元素中,金属性最强的是(填元素符号,下同)________,③④⑤三种元素的原子半径由大到小的顺序是____________。
(2)上述元素的最高价氧化物对应的水化物中酸性最强的是________(填化学式)
(3)元素⑥的氢化物的电子式为____________,该氢化物与元素⑥的最高价氧化物对应的水化物反应的化学方程式为_______________________________________。
【答案】cd A1(OH)3+NaOH= NaAlO2+2H2O ac K Mg>Al>C HClO4 ![]() NH3+HNO3=NH4NO3
NH3+HNO3=NH4NO3
【解析】
I(1)a.l0Be和9Be是同一元素的两种不同种原子,a错误;
b.根据质量数A=质子数Z+中子数N可知,l0Be和9Be具有的中子数分别为6和5,b错误;
c.l0Be和9Be在周期表中的位置相同,故具有相同的化学性质,c正确;
d.l0Be和9Be是具有相同质子数而不同中子数的同一元素的不同原子,故互为同位素,d正确;
故答案为:cd;
(2)A1(OH)3与NaOH溶液反应生成可溶性的NaAlO2和H2O,其化学方程式为:A1(OH)3+NaOH= NaAlO2+2H2O,故答案为:A1(OH)3+NaOH= NaAlO2+2H2O;
(3)a.Mg(OH)2与A1(OH)3分别是Mg和Al的最高价氧化物对应水化物,比较Mg(OH)2与A1(OH)3的碱性强弱来比较Mg和Al的金属性的强弱,a正确;
b.比较这两种元素的最高正化合价,只能说明它们原子的最外层电子数的多少,但与金属性强弱无关,b错误;
c.将打磨过表面积相同的镁条和铝片分别和100℃热水作用,并滴入酚酞溶液,说明Mg与水反应比Al与水反应更剧烈,故可以说明Mg和Al的金属性的强弱,c正确;
d.硬度和熔点属于物质的物理性质,金属性是化学性质,二者毫无联系,比较这两种金属的硬度和熔点不能比较出其金属性的强弱,d错误;
故答案为:ac;
II 从表列出了①~⑩10种元素在周期表中的位置可推知各元素分别为:①为Na,②为K,③为Mg,④为Al,⑤为C,⑥为N,⑦为P,⑧为Cl,⑨为Br,⑩为Ne;
(1)根据同一周期从左往右金属性减弱,同一主族从上往下金属性增强可知上述元素中,金属性最强的是K,同一周期从左往右原子半径逐渐减小,同一主族从上往下原子半径依次增大,故③④⑤三种元素的原子半径由大到小的顺序是Mg>Al>C,故答案为:K; Mg>Al>C;
(2)元素的非金属性越强,其最高价氧化物对应的水化物中酸性越强,同一周期从左往右非金属性增强,同一主族从上往下非金属性减弱,故上述元素的最高价氧化物对应的水化物中酸性最强的是HClO4,故答案为:HClO4;
(3)元素⑥是氮元素,其氢化物NH3的电子式为![]() ,该氢化物NH3与元素⑥的最高价氧化物对应的水化物HNO3反应的化学方程式为:NH3+HNO3=NH4NO3,故答案为:NH3+HNO3=NH4NO3。
,该氢化物NH3与元素⑥的最高价氧化物对应的水化物HNO3反应的化学方程式为:NH3+HNO3=NH4NO3,故答案为:NH3+HNO3=NH4NO3。


科目:高中化学 来源: 题型:
【题目】锰的化合物在工业生产和化学实验中应用广泛,请按要求回答下列问题。
(1)酸性KMnO4溶液可吸收空气污染物甲醛(CH2O),吸收过程中,高锰酸钾溶液逐渐褪色,则甲醛体现___________性。
(2)普通锌锰干电池的总反应为:2MnO2+Zn+2NH4Cl=2MnO(OH)+ZnCl2+2NH3,则放电时MnO2作___________极。(填“正”或“负”)
(3)MnO2能作为双氧水分解的催化剂,其反应可分两步。
第一步为氧化,对应化学方程式为:MnO2+H2O2=Mn(OH)2+O2
第二步为还原,对应化学方程式为:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用电解原理间接氧化法降解处理含有机污染物的废水,其原理如图所示,下列说法错误的是

A.介质离子在电极A上发生氧化反应,电极A为阳极
B.介质离子被氧化得到的强氧化剂可能为Cl2、O2
C.有机污染物在石墨电极上被还原为无污染物质
D.若介质离子为OH-,电极B上发生的反应为2H2O+2e-=H2↑+ 2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当电解质中某离子的浓度越大时,其氧化性或还原性越强。利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的)。实验开始先断开K1,闭合K2,发现电流计指针发生偏转。下列说法错误的是
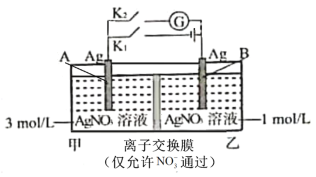
A.断开K1、闭合K2,一段时间后电流计指针归零,此时两池Ag+浓度相等
B.断开K1、闭合K2,当转移0.1mol e-时,乙池溶液质量增加17.0 g
C.当电流计指针归零后,断开K2、闭合K1,一段时间后B电极的质量增加
D.当电流计指针归零后,断开K2、闭合K1,乙池溶液浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式能用来解释相应实验现象的是( )
实验现象 | 离子方程式 | |
A | 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 |
|
B | 向沸水中滴加饱和氯化铁溶液得到红褐色液体 |
|
C | 二氧化硫使酸性高锰酸钾溶液褪色 |
|
D | 氧化亚铁溶于稀硝酸 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性HSO—3>I—,氧化性IO—3>I2。在含0.3mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法不正确的是
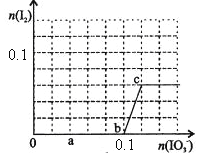
A.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+
B.a点时消耗NaHSO3的物质的量为0.12mol
C.当溶液中I—与I2的物质的量之比为5:2时,加入的KIO3为0.18mol
D.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.一定条件下的可逆反应达到限度时,此条件下反应物的转化率最大
B.化学反应限度的大小主要取决于反应物的性质,且随条件的改变而改变
C.化学反应限度随外界条件的改变而改变的根本原因是外界条件的改变引起v正≠v逆
D.可逆反应的正反应的限度大,正反应的速率就大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、X、Y、Z、W是五种短周期主族元素,原子序数依次增大,其中X、Y、Z同周期,R、W与X、Y、Z不在同一周期,它们可组成某种离子化合物的结构如图所示。下列说法不正确的是( )
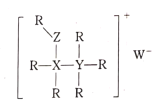
A.原子半径:X>Y>Z>R
B.氢化物的沸点:Z>Y>X
C.X、Y、Z、R可形成多种既能与盐酸反应,又能与NaOH反应的化合物
D.管道工人可用YR3检验输送W2的管道是否泄露
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25°C时,某二元酸H2X及其钠盐的溶液中,H2X、HX-、 X2-分别在三者中所占的物质的量分数(Φ)随溶液pH变化关系如下图所示,下列叙述不正确的是( )
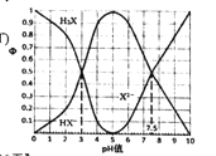
A.在pH=5 的溶液中,存在 =10-4.5
=10-4.5
B.在pH=7.5的溶液中,存在3c(HX-)=c(Na+)+c(H+)-c(OH-)
C.将相同物质的量的Na2X和NaHX完全溶于水所得溶中液的pH值为7.5
D.等体积等浓度的NaOH溶液与H2X溶液混合,溶液显酸性且存在c(H+)+(H2X)=c(OH-)+c(X2-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com