
【题目】锰的化合物在工业生产和化学实验中应用广泛,请按要求回答下列问题。
(1)酸性KMnO4溶液可吸收空气污染物甲醛(CH2O),吸收过程中,高锰酸钾溶液逐渐褪色,则甲醛体现___________性。
(2)普通锌锰干电池的总反应为:2MnO2+Zn+2NH4Cl=2MnO(OH)+ZnCl2+2NH3,则放电时MnO2作___________极。(填“正”或“负”)
(3)MnO2能作为双氧水分解的催化剂,其反应可分两步。
第一步为氧化,对应化学方程式为:MnO2+H2O2=Mn(OH)2+O2
第二步为还原,对应化学方程式为:____________________________________________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,固定容积的容器中可逆反应A(g)+ 3B(g) ![]() 2C(g)未达到平衡状态的是
2C(g)未达到平衡状态的是
A.B的生成速率与B的分解速率相等B.容器内压强不再发生变化
C.单位时间生成nmol A消耗2nmolCD.混合气体的平均摩尔质量是一个定值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取的乙烯常含有少量二氧化硫,现设计如下实验,确认混合气体中有乙烯和二氧化硫。
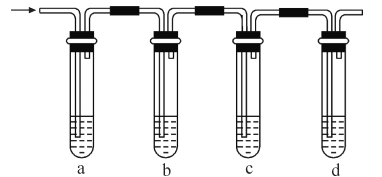
(1)a、b、c、d装置可盛放的试剂是:a_______,b________,c_______,d_______
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性高锰酸钾溶液
(2)b装置的作用是________________________________
(3)确定混合气体中含有乙烯的现象是_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素可以形成多种化合物,如NH3、N2H4、NO、HNO3等。
(1)汽车尾气中含NO和CO,为减轻污染,某市为汽车加装了“三效催化净化器”,可将尾气中的CO、NO转化为可参与大气循环的无毒混合气体,反应的化学方程式为___________________________________。
(2)工业上以惰性材料为电极采用电解法处理汽车尾气中的NO,将NO转化成NH4NO3,用硝酸铵溶液作电解质溶液。当两极转移的电子数目相等时,阳极、阴极上产生含氮物质的物质的量之比为______________(不考虑水解)。
(3) N2H4可作为火箭燃料,其在氧气中燃烧生成一种无毒气体和水。当有16 g N2H4燃烧时,转移电子的数目约为_________________个。
(4)利用氨气可除去工厂烟气中的氮氧化物。写出氨气与氮氧化物(用NOx表示)反应的化学方程式:___________________________________。同温同压下,3.5 L NH3恰好与3.0 L NO和NO2的混合气完全反应,最终转化为N2,则原混合气中NO和NO2的体积之比是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是

A.图甲是常温下用 0.1000 mol·L-1 NaOH 溶液滴定 20.00mL 0.1000 mol·L-1 CH3COOH 的滴定曲线,说明 Q 点表示酸碱中和滴定终点
B.图乙是 1mol X2(g)、1mol Y2(g)反应生成 2mol XY(g)的能量变化曲线,说明反应物所含化学键的键能总和大于生成物所含化学键的键能总和
C.图丙是恒温密闭容器中发生CaCO3(s) CaO(s)+CO2(g)反应时c(CO2)随反应时间变化的曲线,说明t1时刻改变的条件可能是缩小容器的体积
D.图丁是光照盛有少量氯水的恒容密闭容器时容器内O2的体积分数变化曲线,说明光照 氯水有O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年7月5日《科学》杂志在线报道:合成一种新的具有超高热导率半导体材料——砷化硼(BAs)。通过反应4BI3(g) + As4(g)![]() 4BAs(s,晶体) + 6I2(g)可制备BAs晶体。下列说法错误的是()
4BAs(s,晶体) + 6I2(g)可制备BAs晶体。下列说法错误的是()
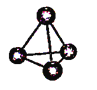
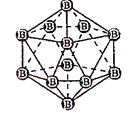
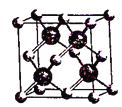
图(a) 图(b) 图(c)
A. 图(a)表示As4结构,As4分子中成键电子对与孤电子对数目之比为3:1
B. 图(b)表示晶态单质硼的B12基本结构单元,该基本单元为正20面体
C. 图(b)所示晶态单质硼的熔点为2180℃,它属于原子晶体
D. 图(c)表示BAs晶胞结构,As原子的配位数为4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li、Na、Mg、C、N、O、S等元素的研究一直在进行中,其单质及化合物在诸多领域都有广泛的应用。回答下列问题:
(1)钠在火焰上灼烧的黄光是一种_____(填字母)
A.吸收光谱;B.发射光谱。
(2)H2S的VSEPR模型为________,其分子的空间构型为________;结合等电子体的知识判断离子N3–的空间构型为________。
(3)Li2O是离子晶体,其晶格能可通过下图的Born-Haber循环计算得到。

可知Li2O晶格能为______kJ·mol-1。
(4)N、O、Mg元素的前3级电离能如下表所示:

X、Y、Z中为N元素的是______,判断理由是_____________________________。
(5)N5–为平面正五边形,科学家预测将来会制出含N4–、N6–等平面环状结构离子的盐,这一类离子中都存在大π键,可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则N4–离子中的大π键应表示为_________。
),则N4–离子中的大π键应表示为_________。
(6)一种Fe、Si金属间化合物的晶胞结构如下图所示:

晶胞中含铁原子为______个,已知晶胞参数为0.564nm,阿伏伽德罗常数的值为NA,则Fe、Si金属间化合物的密度为___________g·cm–3(列出计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.《自然》杂志曾报道我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”。完成下列填空:
(1)l0Be和9Be_____________(填序号)。
a.是同一种原子 b.具有相同的中子数 c.具有相同的化学性质 d.互为同位素
(2)写出A1(OH)3与NaOH溶液反应的化学方程式:_________________________。
(3)研究表明28A1可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是____________(填序号)。
a.比较Mg(OH)2与A1(OH)3的碱性强弱
b.比较这两种元素的最高正化合价
c.将打磨过表面积相同的镁条和铝片分别和100℃热水作用,并滴入酚酞溶液
d.比较这两种金属的硬度和熔点
II.下表列出了①~⑩10种元素在周期表中的位置。
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑤ | ⑥ | ⑩ | |||||
3 | ① | ③ | ④ | ⑦ | ⑧ | |||
4 | ② | ⑨ |
(1)上述元素中,金属性最强的是(填元素符号,下同)________,③④⑤三种元素的原子半径由大到小的顺序是____________。
(2)上述元素的最高价氧化物对应的水化物中酸性最强的是________(填化学式)
(3)元素⑥的氢化物的电子式为____________,该氢化物与元素⑥的最高价氧化物对应的水化物反应的化学方程式为_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com