
【题目】某温度(t℃)时,水的Kw=1×10-13,则该温度(填“大于”、“小于”或“等于”)__25℃,其理由是__。将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,若所得混合液为中性,则a:b=___。
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
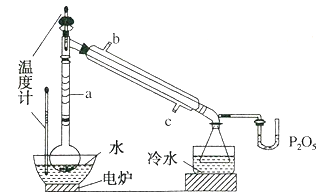
【题目】硼酸三甲酯用作柠檬类水果的熏蒸剂。实验室合成硼酸三甲酯的原理及装置如下:Na2B4O710H2O+2H2SO4+12CH3OH![]() 2NaHSO4+4(CH3O)3B+17H2O
2NaHSO4+4(CH3O)3B+17H2O
已知:
硼酸三甲酯 | 甲醇 | |
溶解性 | 与乙醚、甲醇混溶,能水解 | 与水混溶 |
沸点/℃ | 68 | 64 |
硼酸三甲酯与甲醇混合物的共沸点为54℃ | ||
实验步骤如下:
①在圆底烧瓶中加入44.8g甲醇和191.gNa2B4O710H2O(硼砂,式量为382),然后缓慢加入浓H2SO4并振荡;加热烧瓶中的液体;通过分馏柱回流一段时间。
②先接收51~55℃的馏分,再接收55~60℃的馏分。
③将两次馏分合并,加入氯化钙进行盐析分层,上层为硼酸三甲酯,分离。
④精馏得高纯硼酸三甲酯19.2g。
回答下列问题:
(1)图中仪器a的名称为__;直形冷凝管冷却水应从__(填“b”或“c”)接口进入。
(2)本实验加热方式为__,优点是__。
(3)加入氯化钙盐析分层的主要目的是__。
(4)U型管中P2O3的作用是__。
(5)图中,步骤④的仪器选择及安装都正确的是__,应收集__℃的馏分。
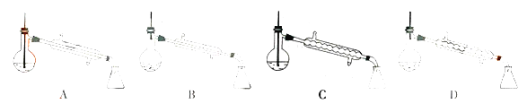
(6)本次实验的产率是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各溶液中微粒的物质的量浓度关系正确的是
①c(NH![]() )相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
②向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
③1.0mol/LNa2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
④某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-)
⑤将pH=6的H2SO4稀释1000倍后,c(H+)=200c(SO![]() )
)
A.①②B.③⑤C.④⑤D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有等体积混合而成的4组气体.①NO2+NO、②NO2+O2、③HCl+N2、④Cl2+SO2.现将其分别通入体积相同的试管中并立即倒立在足量水中,试管内水面上升的高度分别为h1、h2、h3、h4,则高度关系是
A.h4>h2>h3>h1 B.h4>h3>h2>h1
C.h2>h3>h1>h4 D.h3>h2>h1>h4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某煤发电厂处理废气的装置示意图。下列说法错误的是( )
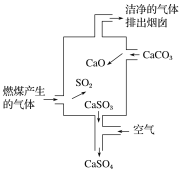
A.使用此废气处理装置可减少酸雨的形成
B.装置内发生的反应有化合、分解、置换和氧化还原反应
C.整个过程的反应可表示为2SO2+2CaCO3+O2===2CaSO4+2CO2
D.可用酸性高锰酸钾溶液检验废气处理是否达标
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤的烟气中常含有大量的NOx、CO、SO2等有害气体,治理污染、消除有害气体对环境的影响是化学工作者研究的重要课题。
Ⅰ.已知氮氧化物可采用强氧化剂Na2S2O8氧化脱除,过程如下所示:
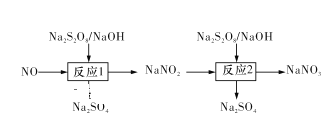
(1)写出反应1的离子方程式:____ 。
(2)反应2为NO2-+S2O82-+2OH-=NO3-+2SO42-+H2O。此反应在不同温度下达到平衡时,NO2-的脱除率与Na2S2O8初始浓度的关系如图1所示。
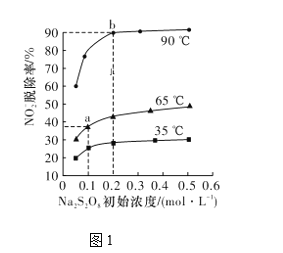
①比较a、b点的反应速率:va正____vb逆(填“>”“<”或“=”)。
②根据图像可以判断该反应为吸热反应,理由是____________。
Ⅱ.沥青混凝土可作为反应2CO(g)+O2(g)![]() 2CO2(g)的催化剂。图2表示在相同的恒容密闭容器、相同的起始浓度、相同的反应时间段下,使用相同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)的催化剂。图2表示在相同的恒容密闭容器、相同的起始浓度、相同的反应时间段下,使用相同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
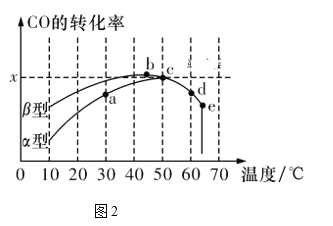
(3)下列关于图2的说法正确的是________。
A.在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要大
B.b点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高
C.a、b、c、d四点中,达到平衡状态的只有b、c两点
D.e点转化率出现突变的原因可能是温度升高后催化剂失去活性
(4)已知c点时容器中O2浓度为0.02 mol/L,则50 ℃时,在α型沥青混凝土中CO转化反应的平衡常数K=_____________(用含x的代数式表示)。
Ⅲ.利用图3所示装置(电极均为惰性电极)可吸收SO2。
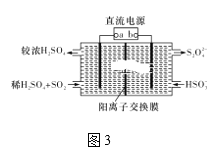
(5)直流电源b极为____,阳极发生的反应为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某样品中所含晶体FeSO47H2O的质量分数,取晶体样品ag,溶于稀硫酸配成100.00mL溶液,取出20.00mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.2000molL-1KMnO4溶液20.00mL,所得晶体中FeSO47H2O的质量分数为__(用a表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在2L的密闭容器中进行如下可逆反应,各物质的有关数据如下:
![]()
起始物质的量浓度/![]() :1.5 1 0
:1.5 1 0
2s末物质的量浓度/![]() :0.9 0.8 0.4
:0.9 0.8 0.4
请回答下列问题。
①该可逆反应的化学方程式可表示为______。
②用物质B来表示![]() 的平均反应速率为______。
的平均反应速率为______。
③从反应开始到2s末,A的转化率为______。
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是______(填序号)
A.![]()
B.容器内气体的总压强保持不变
C容器内气体的密度不变
D.![]()
E.容器内气体C的物质的量分数保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是![]()
A.石灰水与过量碳酸氢钠溶液反应:![]()
B.硫酸氢钠溶液中加入氢氧化钡溶液至中性:![]()
C.氧化铜与稀硫酸反应:![]()
D.碳酸氢钠溶液中加入盐酸:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com