
����Ŀ��ȼú�������г����д�����NOx��CO��SO2���к����壬������Ⱦ�������к�����Ի�����Ӱ���ǻ�ѧ�������о�����Ҫ���⡣
��.��֪��������ɲ���ǿ������Na2S2O8�����ѳ�������������ʾ��
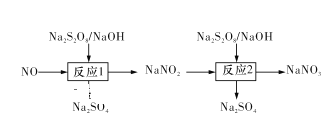
(1)д����Ӧ1�����ӷ���ʽ��____ ��
(2)��Ӧ2ΪNO2-��S2O82-��2OH��=NO3-��2SO42-��H2O���˷�Ӧ�ڲ�ͬ�¶��´ﵽƽ��ʱ��NO2-���ѳ�����Na2S2O8��ʼŨ�ȵĹ�ϵ��ͼ1��ʾ��
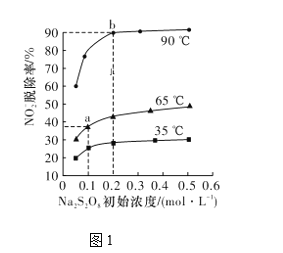
�ٱȽ�a��b��ķ�Ӧ���ʣ�va��____vb��(����>����<����������)��
�ڸ���ͼ������жϸ÷�ӦΪ���ȷ�Ӧ��������____________��
��.�������������Ϊ��Ӧ2CO(g)��O2(g)![]() 2CO2(g)�Ĵ�����ͼ2��ʾ����ͬ�ĺ����ܱ���������ͬ����ʼŨ�ȡ���ͬ�ķ�Ӧʱ����£�ʹ����ͬ�����IJ�ͬ���������(���͡�����)��ʱ��CO��ת�������¶ȵĹ�ϵ��
2CO2(g)�Ĵ�����ͼ2��ʾ����ͬ�ĺ����ܱ���������ͬ����ʼŨ�ȡ���ͬ�ķ�Ӧʱ����£�ʹ����ͬ�����IJ�ͬ���������(���͡�����)��ʱ��CO��ת�������¶ȵĹ�ϵ��
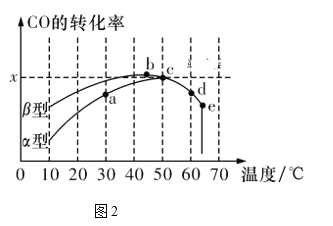
(3)���й���ͼ2��˵����ȷ����________��
A���ھ�δ�ﵽƽ��״̬ʱ��ͬ�������������������COת�����ʱ�����Ҫ��
B��b��ʱCO��O2����֮�䷢����Ч��ײ�ļ���������ʵ����������
C��a��b��c��d�ĵ��У��ﵽƽ��״̬��ֻ��b��c����
D��e��ת���ʳ���ͻ���ԭ��������¶����ߺ����ʧȥ����
(4)��֪c��ʱ������O2Ũ��Ϊ0.02 mol/L����50 ��ʱ�������������������COת����Ӧ��ƽ�ⳣ��K��_____________(�ú�x�Ĵ���ʽ��ʾ)��
��.����ͼ3��ʾװ��(�缫��Ϊ���Ե缫)������SO2��
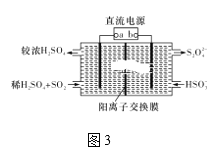
(5)ֱ����Դb��Ϊ____�����������ķ�ӦΪ______��
���𰸡�2NO��S2O82-��4OH��===2NO2-��2SO42-��2H2O < ��Na2S2O8��ʼŨ����ͬʱ���¶�Խ�ߣ�NO![]() �ѳ���Խ��˵��ƽ�������ƶ����÷�ӦΪ���ȷ�Ӧ AD
�ѳ���Խ��˵��ƽ�������ƶ����÷�ӦΪ���ȷ�Ӧ AD ![]() mol/L ���� SO2��2e����2H2O===SO42-��4H��
mol/L ���� SO2��2e����2H2O===SO42-��4H��
��������
���������֪�����⿼�黯ѧƽ���Ӱ�����ؼ���ѧƽ��ļ��㣬������������ԭ�����з�����
��1����Ӧ1��Na2S2O8������������Һ��ͨ��NO���巢��������ԭ��Ӧ���������ơ��������ƺ�ˮ, ��Ӧ�����ӷ���ʽΪ��2NO��S2O82-��4OH��===2NO2-��2SO42-��2H2O,
�ʴ�Ϊ��2NO��S2O82-��4OH��===2NO2-��2SO42-��2H2O��
��2���¶�Խ��NO�ѳ���Խ��˵�����·�Ӧ��������a��b��ķ�Ӧ����va��< vb����
�ʴ�Ϊ��<��
��3������ƽ�������ȷ����ƶ�������Na2S2O8��ʼŨ����ͬʱ���¶�Խ�ߣ�NO![]() �ѳ���Խ��˵��ƽ��������У�����ӦΪ���ȷ�Ӧ��
�ѳ���Խ��˵��ƽ��������У�����ӦΪ���ȷ�Ӧ��
�ʴ�Ϊ����Na2S2O8��ʼŨ����ͬʱ���¶�Խ�ߣ�NO![]() �ѳ���Խ��˵��ƽ�������ƶ����÷�ӦΪ���ȣ�
�ѳ���Խ��˵��ƽ�������ƶ����÷�ӦΪ���ȣ�
(3)A. ��ͼ�ã���ͬ�¶��¦��������������CO�������ʱ�����Ҫ��A��ȷ��
B. a������ݷ�ӳ��CO������������ʵ���������ߵģ���B����
C. ͼ�������֪b�㷴Ӧ�ﵽƽ��״̬������ƽ��������У�a��b��c��d �ĵ��У��ﵽƽ��״̬����bcd, ��C����
D. e�㽵���ʳ���ͻ���ԭ��������¶����ߺ����ʧȥ����ʧЧ����D��ȷ��
�ʴ�Ϊ��AD��
��4������ʼʱCO��Ũ��Ϊ1mol��L��1����ﵽƽ��ʱc(CO)=(1��x)mol/L��c(O2)=0.02mol/L��c(CO2)=xmol/L������ƽ�ⳣ���Ķ��壬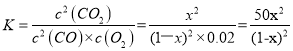
�ʴ�Ϊ��![]() ��
��
��5����װ��ͼ��֪SO2����߷���������Ӧ����SO42-���缫��Ӧ����ʽΪ��SO2��2e����2H2O===SO42-��4H�������a�����ĵ缫Ϊ���ص������������ص��������ӵ��ǵ�Դ�����������aΪ��Դ������bΪ��Դ������
�ʴ�Ϊ��������SO2��2e����2H2O===SO42-��4H����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йؽ����Ĺ�ҵ�Ʒ�����ȷ����
A�����ѣ��ý������ڸ���������TiCl4
B���������ý�̿�Ϳ�����Ӧ������CO�ڸ����»�ԭ����ʯ������������
C�����ƣ��ú�ˮΪԭ���Ƶþ��Σ��ٵ�ⴿ����NaCl��Һ
D����þ���ú�ˮΪԭ�ϣ���һϵ�й����Ƶ�����þ���壬��������ԭ����þ�õ�þ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���A����ʽΪCxHyOz��15gA��������������ȫȼ������22gCO2��9gH2O��
������л�������ʽ_________��
����A��ij����ɫ���д̼�����ζ�����壬���л�ԭ�ԣ���ṹ��ʽ��_______��
����A����Է�������Ϊ180��l molA��������Na��Ӧ����2.5mol�����������ʻ��ܷ���������Ӧ������ѪҺ��A�����������������ṹ��ʽ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й������У���ȷ����
A. һ���¶��£���0.1mol/L�İ�ˮ�еμ���ͬŨ�ȵĴ��ᣬc(NH4+)/c(NH3��H2O) ��С
B. ��֪Ksp(BaSO4) = 1.1��10��10�� Ksp(BaCO3) = 2.58��10��9�����Բ��ܽ�BaSO4ת��ΪBaCO3
C. ��������Һ�ζ�ǿ����Һʱ���ü�����ָʾ��
D. ����FeCl3��Һʱ��Ϊ������ˮ�⣬�ɼ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶ȣ�t�棩ʱ��ˮ��Kw=1��10-13������¶ȣ���������������С����������������__25�棬��������__�������¶���pH=11��NaOH��ҺaL��pH=1��H2SO4����ҺbL��ϣ������û��ҺΪ���ԣ���a��b=___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ����������ȼ�ϵ�صĹ���ԭ����ͼ���õ�ط�ӦΪ��Mg+ClO��+H2O�TMg��OH��2+Cl�������й�˵����ȷ���ǣ�������

A. ��ع���ʱ��C��Һ�е�������MgCl2
B. ��ع���ʱ������a������pH����������
C. ������Ӧʽ��ClO����2e��+H2O�TCl��+2 OH��
D. b�缫������ԭ��Ӧ��ÿת��0.1mol���ӣ�����������0.1mol Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��CΪ��ѧ�������ʣ�����һ��Ϊ������ͨ�������AΪ���塢BΪ����ɫ���塢CΪ��ɫ���塣D��E��F��G��H��X��Ϊ���������X����������ɫ���壬��ˮ��Һ��һ������ǿ����Һ��EΪ��ɫ���壬H�ڳ�����ΪҺ�塣����֮���ת����ͼ��ʾ��ijЩ��Ӧ�����Ͳ��ַ�Ӧ��������ȥ����
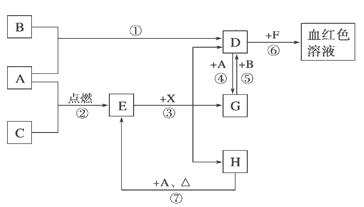
��1��д���������ʵĻ�ѧʽ��D X ��
��2���ڷ�Ӧ�١����У�������������ԭ��Ӧ���� �����ţ���
��3����Ӧ�����ӷ���ʽΪ�� ��
��4����G��Һ�м���NaOH��Һ�۲쵽�������� ��
��5����Ӧ�ߵĻ�ѧ����ʽΪ ���÷�Ӧ��ÿ����0.3mol��A����ת�Ƶ��� mol��
��6����ȥD��Һ�л��е�����G�ķ����ǣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л���(a)![]() ��˵���������
��˵���������
A.a��b��c�ķ���ʽ��ΪC8H8
B.b������ԭ�ӿ��ܴ���ͬһƽ��
C.c�Ķ��ȴ�����4��
D.a��b��c����ʹ��ˮ������KMnO4��Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ�����ˡ�������2016��ʮ���¼���֮һ��̼������أ����ԭ����ͼ��ʾ����֪��������Al2(C2O4)3��������ˮ���������й�˵����ȷ����
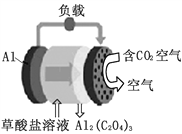
A. ��װ�ý�����ת��Ϊ��ѧ��
B. �����ĵ缫��ӦΪC2O42��-2e-===2CO2
C. ÿ����1molAl2(C2O4)3����6mol������������
D. ��������Һ�е�����������Al�缫
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com