

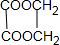 ,故答案为:
,故答案为: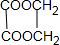 ;
;| 浓硫酸 |
| △ |
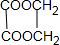 +2H2O,故答案为:HOOC-COOH+HOCH2CH2OH
+2H2O,故答案为:HOOC-COOH+HOCH2CH2OH| 浓硫酸 |
| △ |
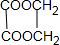 +2H2O;
+2H2O;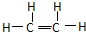 ,故答案为:
,故答案为: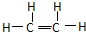 .
.


科目:高中化学 来源: 题型:
 如图所示装置组成一种原电池.试回答下列问题:
如图所示装置组成一种原电池.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | NaOH起始读数 | NaOH终点读数 |
| 第一次 | 0.10mL | 18.60mL |
| 第二次 | 0.30mL | 18.00mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应温度 | Na2S2O3 | H2SO4 | H2O | |||
| ℃ | V(mL) | c(mol?L-1) | V(mL) | c(mol?L-1) | V(mL) | |
| A | 10 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
| C | 30 | 5 | 0.1 | 5 | 0.1 | 10 |
| D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


| 实验方法 | 实验现象 | 结论 |
| 步骤1:在滤液A中加入 | 滤液A中有Fe3+ | |
| 步骤2:在滤液A中加入 | 滤液A中有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、沉淀2放置在空气中,若质量增加,试样中肯定操作SO32- |
| B、试样溶液中加入稍过量的NH4Cl溶液能得到与沉淀1成分相同的物质 |
| C、上述流程步骤(1)(2)(3)的顺序改为(3)(2)(1),可能会获得相同的实验现象 |
| D、试样溶液中肯定操作AlO2-、Cl-,其中Na+、K+至少操作1种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲酸、乙酸、甲酸钠溶液、乙酸乙酯 |
| B、乙烯、乙烷、乙炔、丙烯 |
| C、苯酚、乙醇、苯、四氯化碳 |
| D、苯乙烯、苯酚、乙苯、甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 的主链碳原子数是
的主链碳原子数是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com