
【题目】从镍矿石尾矿中提取NiSO4是解决我国镍资源匮乏的一条重要途径,已知该过程如下:
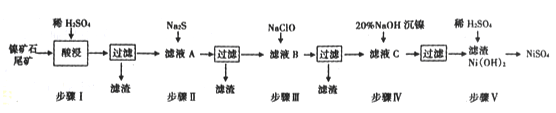
表1:各物质的Ksp数据如下表:
物质 | MnS | NiS | PbS | CuS | Ni(OH)2 |
Ksp | 2.5×10-13 | 1.1×10-21 | 8.0×10-28 | 6.3×10-36 | 2.0×10-15 |
表2:滤液A中各金属离子的含量如下表:
成分 | Ni2+ | Fe3+ | Fe2+ | Mn2+ | Cu2+ | Pb2+ | …… |
3.80 | 4.80 | x | 0. 20 | 0.15 | <0.001 | …… |
根据以上信息,回答下列问题:
(1)步骤I酸浸之前需将矿石粉碎,目的是____________。
(2)若杂质离子的浓度c≤1.0×10-5mol/L即可认定沉淀完全,则步骤Ⅱ中当Pb2+“恰好沉淀完全时,溶液中硫离子的浓度c(S2-)=_____________
(3)常温下进行步骤Ⅲ的目的是为了除去铁和锰元素,已知除铁元素的离子反应如下:
2Fe2++ ClO - +5H2O=2Fe( OH)3↓+Cl-+4H+
此时Mn2+的氧化产物为MnO2,写出除锰元素的离子方程式______________。
(4)为测定滤液A中Fe2+离子的含量,(每升溶液中含有的亚铁离子的质量,以g/L表示)每次移取20.00 mL待测液,并用0.02 mol/L的KMnO4溶液滴定,若已知其他离子均不反应,且三次滴定平均消耗KMnO4溶液18. 00mL,则x的值为________(精确到小数点后两位)。
(5)所得Ni(OH)2是制造镍镉电池的重要原料,镍镉电池工作原理如下:
Cd+2NiO(OH) +2H2O![]() Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
则随着放电的进行,正极区pH______(填“增大”、“减小”或“不变”);充电时阴极电极反应式为______。
【答案】 增大接触面积,提高浸取率 8.0×l0-23 否 Mn2+ +ClO-+H2O =MnO2↓+Cl- +2H+ 5.04g/L 增大 Cd(OH)2 +2e-=Cd+2OH-
【解析】(1)步骤I酸浸之前需将矿石粉碎,可以增大接触面积,提高浸取率,故答案为:增大接触面积,提高浸取率;
(2)若杂质离子的浓度c≤1.0×10-5mol/L即可认定沉淀完全,则步骤Ⅱ中当Pb2+恰好沉淀完全时,溶液中硫离子的浓度c(S2-)=![]() = 8.0×l0-23;对于Ni2+,Qc=3.80×8.0×l0-23<1.1×10-21,Ni2+没有开始沉淀,故答案为:8.0×l0-23;否;
= 8.0×l0-23;对于Ni2+,Qc=3.80×8.0×l0-23<1.1×10-21,Ni2+没有开始沉淀,故答案为:8.0×l0-23;否;
(3)根据除铁元素的离子反应2Fe2++ ClO - +5H2O=2Fe( OH)3↓+Cl- +4H+,可知,氧化剂为次氯酸根离子,次氯酸根离子将Mn2+氧化为MnO2,除锰元素的离子方程式为Mn2+ +ClO-+H2O =MnO2↓+Cl- +2H+,故答案为:Mn2+ +ClO-+H2O =MnO2↓+Cl- +2H+;
(4) 消耗高锰酸钾的物质的量为0.02 mol/L×0.018L=0.00036mol,反应中转移电子0.00036mol×(7-2)=0.0018mol,根据得失电子守恒,Fe2+的物质的量=0.0018mol,每升溶液中含有的亚铁离子的含量为0.0018×56×![]() =5.04g/L,故答案为:5.04g/L;
=5.04g/L,故答案为:5.04g/L;
(5)根据总反应,正极的电极方程式为NiOOH+H2O+e-=Ni(OH)2+OH-,随着放电的进行正极区pH增大,充电时阴极电极反应式为Cd(OH)2 +2e-=Cd+2OH-,故答案为:增大;Cd(OH)2 +2e-=Cd+2OH-。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图所示装置(夹持装置等已省略),其实验操作为:先按图安装好装置,关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)地通入气体,即可在M处观察到明显的实验现象。试回答以下问题:

(1)A中发生反应的化学方程式:_____________________________________,
B的作用:_____________________;C中热水的作用:________________________________。
(2)M处发生反应的化学方程式为________________________________。
(3)从M管中可观察到的现象:_________________________________。
(4)实验进行一段时间后,如果撤掉酒精灯,反应__(填“能”或“不能”)继续进行,其原因是______________________________________________________________________。
(5)验证乙醇氧化产物的化学方法是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铜加入一定量稀硫酸和过氧化氢混合溶液中,充分反应后,溶液呈蓝色,有无色气体产生;若还发现容器底部有少量固体,则该固体可能是( )
A.Cu
B.S
C.CuS
D.Cu2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于35℃的0.1mol/L NaOH溶液,以下表述错误的是( )
A.Kw>1×10﹣14
B.水电离的c(H+)>1×10﹣13 mol/L
C.pH>13
D.c(OH﹣)=c(H+)+c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中硫元素为-1价)在高温下和氧气反应制备SO2:
4FeS2+11O2![]() 8SO2+2Fe2O3,该反应中被氧化的元素是________(填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为________ L。
8SO2+2Fe2O3,该反应中被氧化的元素是________(填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为________ L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3的熔点为16.8 ℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响)
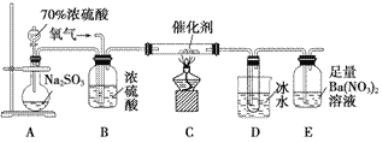
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:__________________。
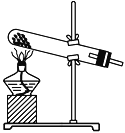
②实验过程中,需要通入氧气。试写出一个用如下图所示装置制取氧气的化学方程式:________________________________________________________________________。
③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是________________________________________________________________________。
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是________(用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如图装置验证二氧化硫的化学性质。
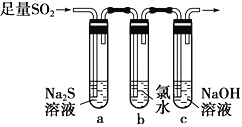
①能说明二氧化硫具有氧化性的实验现象为___________________________________。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案中合理的是________(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗痫灵(G)具有抗癫痫、抗惊厥、抗抑郁等功效,其合成路线如下图所示(某些反应条件和副产物已略):

(1)A中含氧官能团名称是______;简述证明A含有该官能团的实验方法:_________。
(2)若以醛基为母体,则B的系统命名法的名称为_______;①~⑥的反应中属于加成反应的是____ (填序号)。
(3)芳香化合物H是C的同分异构体,H的相关信息如下:
a.可发生银镜反应; b.可与NaHCO3溶液反应生成气体;c.苯环上的一溴代物有2种,则H的结构简式为__________。
(4)写出反应⑥的化学反应方程式:_____________。
(5)( )的单体是薰衣草的调和香料,以苯甲醛(
)的单体是薰衣草的调和香料,以苯甲醛(![]() )为起始原料(其余有机、无机原料任选),参照G的合成,设计并补充完成下列合成路线图:__________(空格内有几步,写几步。)
)为起始原料(其余有机、无机原料任选),参照G的合成,设计并补充完成下列合成路线图:__________(空格内有几步,写几步。)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素,按照原子半径依次减少,第一电离能依次增大的顺序排列的是( )
A. Ca、Mg、BeB. Na、Mg、AlC. C、N、OD. P、S、Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质按纯净物、胶体、电解质、氧化物的顺序组合的一组为( )
A. 稀盐酸、氨水、硫酸、干冰
B. 蒸馏水、淀粉溶液、碳酸氢钠、二氧化硫
C. 胆矾、雾、铁、石膏
D. 生石灰、泥水、氯化铜、碳酸钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com