
【题目】将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为_____L,NO2的体积为______L。
(2)参加反应的硝酸的物质的量是_______mol。
(3)待产生的气体全部释放后,向溶液加入VmL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为___________mol/L。(结果不需化简)
(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水________g。
【答案】 5.376 5.824 1.52 ( av·10-3+0.5)/0.14 57.8
【解析】铜的物质的量为n(Cu)=![]() =0.51mol,混合气体的物质的量为n(NO)+n(NO2)=
=0.51mol,混合气体的物质的量为n(NO)+n(NO2)=![]() =0.5mol,(1)设NO为xmol,NO2为ymol,电子得失守恒得:3x+y=0.51×2,气体的总物质的量为x+y=0.5,解之得x=0.26,y=0.24,则V(NO)=0.26mol×22.4L/mol≈5.8L,V(NO2)=0.24mol×22.4L/mol≈5.4L;(2)铜与硝酸反应,反应生成硝酸铜、NO和NO2,由N原子守恒:参加反应的硝酸n(HNO3)=2n(Cu(NO3)2)+n(NO)+n(NO2)=0.51mol×2+0.5mol=1.52mol。(3)当Cu2+全部转化成沉淀时,溶液中的溶质为NaNO3,根据氮元素守恒,HNO3的物质的量为n(Na+)+n(NO)+n(NO2),n(Na+)=n(NaOH)=aV×10-3mol,n(NO)+n(NO2)=0.5mol,则原硝酸溶液的浓度为
=0.5mol,(1)设NO为xmol,NO2为ymol,电子得失守恒得:3x+y=0.51×2,气体的总物质的量为x+y=0.5,解之得x=0.26,y=0.24,则V(NO)=0.26mol×22.4L/mol≈5.8L,V(NO2)=0.24mol×22.4L/mol≈5.4L;(2)铜与硝酸反应,反应生成硝酸铜、NO和NO2,由N原子守恒:参加反应的硝酸n(HNO3)=2n(Cu(NO3)2)+n(NO)+n(NO2)=0.51mol×2+0.5mol=1.52mol。(3)当Cu2+全部转化成沉淀时,溶液中的溶质为NaNO3,根据氮元素守恒,HNO3的物质的量为n(Na+)+n(NO)+n(NO2),n(Na+)=n(NaOH)=aV×10-3mol,n(NO)+n(NO2)=0.5mol,则原硝酸溶液的浓度为![]() mol/L;(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,由得失电子守恒可得n(H2O2)×2=3n(NO)+n(NO2)0.26mol×3+0.24mol,n(H2O2)=0.51mol,m(H2O2)=0.51mol×34g/mol/30%=57.8g.
mol/L;(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,由得失电子守恒可得n(H2O2)×2=3n(NO)+n(NO2)0.26mol×3+0.24mol,n(H2O2)=0.51mol,m(H2O2)=0.51mol×34g/mol/30%=57.8g.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】列实验方案能达到目的是( )
A. 除去NaCl固体中混有的MgCl2:加入KOH试剂后过滤
B. 实验室获取少量纯净的水:蒸馏自来水
C. 提纯混有少量硝酸钾的氯化钾:将混合物溶于热水中,再冷却、结晶并过滤
D. 提取碘水中的碘:加入适量乙醇,振荡、静置、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列化学反应的离子方程式的是( )
A.稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
B.氧化镁与稀硫酸混合:MgO+2H+=Mg2++H2O
C.铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag
D.碳酸钙溶于稀盐酸中:CO32-+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修:物质结构与性质】
金属钛(22Ti)号称航空材料。回答下列问题:
(1)钛元素基态原子未成对电子数为________个,能量最高的电子占据的能级符号为___________,该能级所在能层具有的原子轨道数为_____________。
(2)[Ti(OH)2(H2O)4]2+中的化学键有_____________。
a.σ键 b.π键 c.离子键 d.配位键
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图所示。

化合物甲的分子中采取sp2杂化方式的碳原子个数为__________,化合物乙中采取sp3杂化的原子的第一电离能由小到大的顺序为____________。
(4)工业上制金属钛采用金属还原四氯化钛。先将TiO2(或天然的金红石)和足量炭粉混合加热至1000~1100K,进行氯化处理,生成TiCl4.写出生成TiCl4的化学反应方程式:_______________。
(5)有一种氮化钛晶体的晶胞如图所示,该晶体的化学式为____________,该晶体中Ti原子周围与距离最近且相等的 N原子的个数为___________。已知晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则晶胞边长为________cm(用含ρ、NA的式子表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种原子序数依次增加的短周期元素,其中A的最低负价和最高正价代数和为零,且A2常温下为气态,B与其他元素形成的化合物种类最多,C与E可形成EC2和EC3两种物质,D是短周期最活泼的金属元素,用化学用语回答下列问题:
(1)D离子结构示意图________,用电子式表示BC2形成过程____________;
(2)A与C形成含18个电子的化合物的电子式是_________________;
(3)C与D形成的一种化合物颜色为淡黄色,其阴阳离子个数比为______,电子式为________,所含化学键为___________;
(4)B、E两元素得电子能力B____E(填“>”或“<”),试写出证明该结论的一个化学方程式__________;
(5)工业上常用足量氨水吸收尾气中的EC2,离子方程式为_______,检验其中阳离子的方法是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx会引起光化学烟雾等环境问题,在催化剂存在条件下,以NH3或尿素将尾气中NOx
还原为N2的技术,即NH3或尿素-SCR技术,是去除NOx最为有效且应用最广的技术之一,其中最重要的催化剂体系是钒基催化剂。
(1)NH3去除尾气中的NOx,当v(NO):v(NO2)=l:1时称为“快速SCR 反应”,该反应化学方程式为___________。
(2)不同钒含量的催化剂(V2O5/TiO2)添加WO3对NO去除率的影响如下图,从图中可以得出其它条件相同时添加WO3,对NO去除率的影响是_____(填“增大”、“减小”或“无影响”)。根据图中所示,随着温度升高NO去除率的变化趋势为_____,该变化趋势的一种可能原因是___________。

(3)在制备钒基催化剂时,添加的各种成型助剂中碱金属或碱土金属(如Na、K、Ca)能够使催化剂中毒(催化性能下降), K、Ca的毒化作用与Na相似。下列适合做成型助剂有_____。
A.Li B.Mg C.酸性铝溶胶 D.酸性硅溶胶
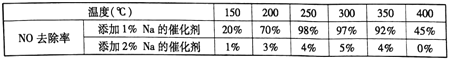
请设计实验研究添加金属K对催化剂活性的影响(只需写出实验思路,不需要具体实验
操作)_____________。
(4)在NOx催化去除过程中,NH3储罐存在危险性,更多应用为尿素-SCR技术。在该技术过程中,发生如下两个反应:
① CO(NH2)2=NH3+HNCO
② HNCO(g)+H20(g)====NH3(g)+CO2(g)
在此过程中一分子尿素可以生成两分子NH3,因此尿素被视为是NH3的有效储存源。反应②的平衡常数表达式为_______。目前商用的尿素溶液浓度为32.5%(密度为1.05g/mL),常称为“Ad Blue ”。1L该商用尿素溶液发生“快速SCR反应”, 理论上最多可消除NO和NO2在标准状况下的体积为______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的 X 置于某 10 L 容积恒定的真空容器中(假设固体试样体积忽略不计),在恒定温度下使其达到分解平衡:X(s)![]() 2Y(g)+Z(g),实验测得不同温度下的分解平衡常数列于下表,下列说法中不正确的是( )
2Y(g)+Z(g),实验测得不同温度下的分解平衡常数列于下表,下列说法中不正确的是( )
温度( oC) | 15.0 | 25.0 | 30.0 | 35.0 |
K/(×10-8 mol3·L-3) | 0.205 | 1.64 | 4.68 | 10.8 |
A.若Z的体积分数不再随时间变化时表示反应达平衡状态
B.35 oC时,达平衡时,X分解了 0.03 mol
C.该反应在高温下可能自发
D.若在恒温下,压缩容器体积,再次达平衡后,n(X)比原平衡大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于植物细胞中元素的叙述,错误的是
A. 番茄和水稻根系吸Si元素的量有差异
B. 细胞中含量最多的四种元素是C、O、H和N
C. 植物根系通过主动运输吸收无机离子需要ATP
D. 细胞膜的选择透过性与膜蛋白有关,与脂质无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
铜是人类最早发现的金属,也是人类广泛使用的一种金属。铜及其化合物在工业、工程技术和工艺上有着广泛的应用。
(1)早期发现的天然准晶颗粒由Cu、Fe、Al三种金属元素组成。Fe元素位于元素周期表的____区。基态Al原子的L层电子排布图为___________。
(2)Cu2O为半导体材料,可由乙醛(CH3CHO)和新制氢氧化铜反应得到,同时可得到乙酸。乙醛中碳原子的杂化轨道类型为_________,1mol乙酸分子中含有的σ键的数目为____________。
(3)制造单晶硅太阳能电池片时,一般掺杂微量的铜、碳、硼、氮等。一价铜离子的电子排布式为____。碳、硼、氮元素的电负性由大到小的顺序是_____。(用元素符号表示)
(4)在络离子[Cu(NH3)4]2+中NH3的VSEPR模型为_________。
(5)铜银合金晶体具有面心立方最密堆积结构。在晶胞中,Cu原子位于面心,Ag原子位于顶点,若该晶胞边长为r pm,则合金的密度为____g·cm-3(设阿伏伽德罗常数的值为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com