
锌片与2mol/L H2SO4反应制取氢气时,下列措施能使氢气生成速率加快的是( )
A.向反应体系中加入5mol/L的硝酸溶液提高氢离子浓度
B.将稀H2SO4改用98%浓H2SO4
C. 向反应体系中立即加入大量CuSO4溶液
D. 向反应体系中加入4.5mol/L的盐酸溶液
D. 反应进行80s时,X物质的量浓度为0.04mol/L
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列各组离子中,能在指定溶液中大量共存的是
A.澄清透明的溶液:ClO-、MnO4-、Al3+、SO42-
B.常温下c(H+)/c(OH-)=1012的溶液:Na+、SO42-、S2O32-、Cl-
C.无色溶液中:Cl–,I-,Na+,ClO-
D.含有大量AlO2-的溶液:CO32-、K+、SO42-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层电子都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组同学查到一份研究过氧化氢溶液与氢碘酸(HI)反应的实验资料,具体如下:
资料1:室温下,过氧化氢溶液可与氢碘酸(HI)反应,溶液为棕黄色。
资料2:实验数据如下表所示。
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| 实验条件 | 保持25℃,101kP条件下 | ||||
| c(H2O2) | 0.1 | 0.1 | 0.1 | 0.3 | 0.3 |
| c(HI) | 0.1 | 0.2 | 0.3 | 0.1 | 0.1 |
| 出现棕黄色时间/s | 13.1 | 6.5 | 4.3 | 4.4 | 4.4 |
(1) 过氧化氢溶液与氢碘酸(HI)反应的化学方程式为 。
(2)①观察资料2中实验编号为1-3数据,分析解释出现棕黄色由慢变快的原因是 。
②该组同学对编号4、5的实验分别升高不同温度,发现升高温度较小的一组,棕黄色出现加快,升高温度较大的一组,棕黄色出现反而变慢,
请你给与分析解释 。
(3)该小组同学欲用碘化钾替代氢碘酸验证上述实验。在实验过程中,未观察到溶液变为棕黄色,却观察到产生无色气体。于是,该小组同学提出假设:KI可能是过氧化氢分
解反应的催化剂(实验室提供KI溶液),并设计如下实验验证其假设。
实验步骤:
I. 取2支试管,向试管1中加入2 mL 0.1 mol/L H2O2溶液,向试管2中加入…….。
II. ……。
III.分别将2支试管置于40℃水浴中。
①补全实验步骤
I: 。
II: 。
②实验现象证明该小组同学假设成立,该实验现象是 。
(4)实验后,该小组同学进一步查阅资料,发现了如下图所示的数据关系,并根
据该数据图提出了如下新假设: 。
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)将3p%的硫酸与同体积的p%的硫酸混合得到q%的稀硫酸,则p、q的关系正确的是________(填序号,下同)。
①q=2p ②q>2p
③q<2p ④无法确定
(2)若上题中的溶质是乙醇而非硫酸,则p、q的关系是________。
①q=2p ②q>2p
③q<2p ④无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100 mL pH为2、浓度约为0.1 mol·L-1的NH4Al(SO4)2溶液,配制过程为:
①用托盘天平称量NH4Al(SO4)2·12H2O固体_______________________________g;
②将上述固体置于烧杯中,______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有X、Y、Z、W、Q五种短周期元素,它们在周期表中的位置如图所示。下列说法不正确的是( ) 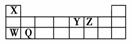
A.W的单质和某些化合物可用于道路照明、漂白剂、制玻璃等
B.含W、Y、Z三种元素的化合物,其水溶液可能呈中性或碱性
C.X与Y、X与Z形成的简单化合物,分子间都能形成氢键,并且均具有氧化性和还原性
D.Y与Z形成的化合物只有5种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com