
【题目】欲提纯混有硫酸钠、碳酸氢铵的氯化钠固体,某学生设计了如下方案:
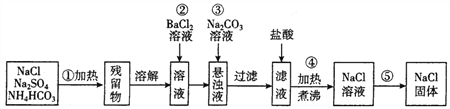
请根据操作流程回答下列问题:
(1)操作①在加热时应选择_________盛装混合物(填仪器名称)。
(2)进行操作②后,判断SO42-已沉淀完全的方法是_________。
(3)操作③的离子方程式为_________。
(4)操作④的目的是_________。
(5)实验室进行操作⑤的具体步骤是_________。
(6)某同学欲用制得的氯化钠固体配制100mL0.2mol·L-1的氯化钠溶液。
①配制NaCl溶液时需用到的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、_________。
②下列操作会使所配氯化钠溶液浓度偏小的是_________(请填序号)。
A.加水定容时俯视刻度线
B.容量瓶内壁附有水珠而未干燥处理
C.在溶解过程中有少量液体溅出烧杯外
D.颠倒摇匀后发现凹液面低于刻度线又加水补上
【答案】 坩埚 静置,往上层清液中维续滴加BaCl2溶液,若不出现浑浊,则SO42-已沉淀完全 Ba2++CO32-=BaCO3↓ 除去溶解在溶液中过量的HCl和CO2 将溶液置于蒸发皿中,加热蒸发,并用玻璃棒不断搅拌,加热蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干 胶头滴管、100mL容量瓶 CD
【解析】由分离流程可知,①为加热,碳酸氢铵分解生成水、氨气、二氧化碳,残留物为NaCl、硫酸钠,溶解后加氯化钡除去硫酸根离子,再加碳酸钠除去钡离子,过滤除去沉淀硫酸钡、碳酸钡,向滤液中加盐酸,与碳酸钠反应生成NaCl,最后蒸发得到纯净的NaCl,则
(1)固体加热需要在坩埚中进行。(2)判断SO42-已除尽的方法为静置,往上层清液中维续滴加BaCl2溶液,若不出现浑浊,则SO42-已沉淀完全。(3)根据以上分析可知操作③的离子方程式为Ba2++CO32-=BaCO3↓。(4)根据以上分析可知操作④的目的是除去溶解在溶液中过量的HCl和CO2。(5)操作⑤是蒸发,具体步骤是将溶液置于蒸发皿中,加热蒸发,并用玻璃棒不断搅拌,加热蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干。(6)①配制NaCl溶液时需用到的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、100mL容量瓶。②A.加水定容时俯视刻度线,溶液体积减少,浓度偏高,A错误;B.容量瓶内壁附有水珠而未干燥处理不影响,B错误;C.在溶解过程中有少量液体溅出烧杯外溶质减少,浓度偏低,C正确;D.颠倒摇匀后发现凹液面低于刻度线又加水补上,溶液体积增加,浓度偏低,D正确,答案选CD。


科目:高中化学 来源: 题型:
【题目】向500mL稀硝酸中加入一定质量的铁粉,铁粉完全溶解后,放出NO气体5.6L(标准状况),同时溶液质量增加9.3g,下列判断正确的是( )
A.原溶液中投入铁粉物质的量是0.25mol
B.原溶液中的HNO3浓度是2.0mol/L
C.反应后的溶液中还可以溶解9.6g铜
D.反应后的溶液中c(Fe2+):c(Fe3+)=1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下面的装置中,A是实验室制备Cl2的发生装置,圆底烧瓶中盛放的是二氧化锰,C、D为气体净化装置;E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶:烧杯G为尾气吸收装置。试回答:
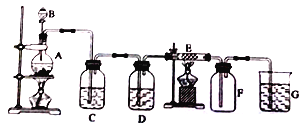
(1)C装置中试剂为______。
(2)E中的现象为______。
(3)写出在A、G中发生反应的离子方程式:A: ___________。G: ________________。
(4)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:2 KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
①考试用“单线桥”标出电子转移的方向和数目: __________。
②该反应中被氧化和未被氧化的HCl的物质的量之比是________,如果将20mL、12mol/L的浓盐酸与足量KMnO4充分反应,实际能收集到氯气在标准状况下的体积为_______。
A.≥1.68L B.>1.68L C.≤1.68L D.<1.68L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苦杏仁酸(D)是一种重要的医药中间体,可通过下列方法合成: 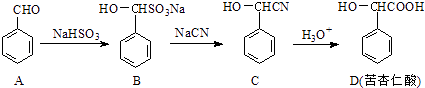
①A→B的反应类型为
②D能缩聚为聚酯,聚酯的结构简式为
③E是D的同分异构体,E中含有苯环,且E能发生如下水解反应:E+H2O ![]() CH3OH+F符合条件的F的结构种,其中核磁共振氢谱有4组峰且面积比为1:2:2:1的结构简式为 .
CH3OH+F符合条件的F的结构种,其中核磁共振氢谱有4组峰且面积比为1:2:2:1的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过滤是水净化过程中的一道重要工序,它能( )
A. 给水消毒,达到饮用标准B. 将污水转化为纯水
C. 除去水中的异味D. 除去水中的不溶性杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白酒、食醋、蔗糖、淀粉等均为家庭厨房中常用的物质,利用这些物质能完成的实验是( )
①检验自来水中是否含有Cl- ②鉴别食盐和小苏打 ③蛋壳能否溶于酸 ④白酒中是否有甲醇
A.①②
B.①④
C.②③
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在某温度下测定溶液的pH时发现,0.01mol/L的NaOH溶液中,c(H+)c(OH﹣)=10﹣12(mol/L)2 , 则该小组在该温度下测得0.1mol/LNaOH溶液和0.1mol/LHCl溶液pH应为( )
A.13、1
B.13、2
C.11、1
D.10、2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时0.1molL﹣1 HA溶液的pH=3,0.1molL﹣1 BOH溶液中c(OH﹣):c(H+)=1012 , 将两溶液等体积混合,以下判断正确的是( )
A.c(H+)+c(HA)=c(OH﹣)
B.c(OH﹣)<c(H+)<c(B+)<c(A﹣)
C.c(H+)+c(B+)<c(A﹣)+c(OH﹣)
D.c(A﹣)=c(B+)>c(H+)=c(OH﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com