
【题目】下列说法正确的是( )
A.甲醇是一种常见的醇,俗称木精或木醇
B.沸点:戊烷>2,2-二甲基戊烷>2,3-二甲基丁烷>丙烷
C.钠融法可以测定有机物的结构
D.木糖醇( ![]() )和葡萄糖互为同系物,均属于糖类
)和葡萄糖互为同系物,均属于糖类
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1molL-1NH4HSO4溶液中逐滴加入0.1molL-1的NaOH溶液,溶液中由水电离出的c水(H+)与所加NaOH溶液的体积的关系如图所示。下列分析正确的是( )
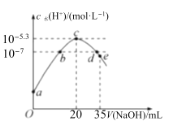
A.c点之前,主要的反应为NH4++OH-═NH3H2O
B.b点和d点对应溶液的pH均为7
C.常温下,Kb(NH3H2O)=5×10-5.4molL-1
D.d点溶液中,c(Na+)+c(NH4+)=c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.0.1molH2和0.1molI2(g)于密闭容器中充分反应,容器内原子总数为0.2NA
B.常温常压下,28gFe和足量浓硝酸混合,转移电子数为1.5NA
C.标准状况下22.4LHF中含有的氟原子数目为NA
D.2gD2O和H2l8O混合物中所含中子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和滴定不仅可以测定酸或碱的物质的量浓度,还可以测定某些混合物的含量。
烧碱是重要的化工原料,工业烧碱中可能含有少量NaCl。为测定工业烧碱样品中NaOH的质量分数,进行如下实验:
①称取1. 000g样品,配制成250mL待测液。
②量取20.00mL待测液,用0.1000mol/L标准盐酸溶液滴定。
(1)将1.000g样品配成250mL待测液,所用的玻璃仪器有:烧杯、玻璃棒、胶头滴管 _____________________________________;
(2)量取20.00mL待测液所用的仪器是_______________________;选用的指示剂为_____________________。
(3)滴定操作过程中,眼睛应注视____________________________________________;判断达到滴定终点的依据为_______________________________________________。
(4)第一组学生在测定时,标准盐酸滴过了头,该组学生又加了2.80mL待测液,继续做实验,这种操作__________(填:合理或不合理)。
(5)第二组学生在滴定过程中,不小心将标准液滴在锥形瓶的内壁上,一学生提议用蒸馏水将液滴冲下去,你认为这样操作使结果_______ (填:偏高、偏低或没有影响)。
(6)第三组学生进行了两次滴定,消耗标准盐酸体积的数据如表,其中第2次滴定后滴定管的读数如图所示,将这一读数填入表中。
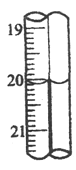
次数 | 滴定前(mL) | 滴定后 |
1 | 0.40 | 20.10 |
2 | 0.10 | ____________ |
该组学生所测得的烧碱样品中NaOH的质量分数为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为苯和溴取代反应的改进实验装置。其中A为带支管的试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑。
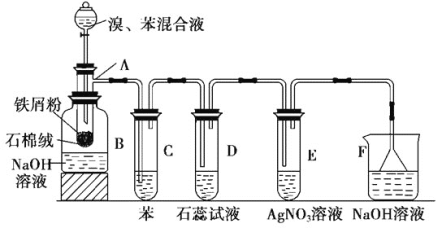
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):______该反应的类型为______反应。
(2)试管C中苯的作用是_________;反应开始后,观察D试管,看到的现象为____________;
(3)在上述整套装置中,具有防倒吸作用的仪器有______(填字母)。
(4)改进后的实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这三个优点外,还有一个优点是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若规定碳12的相对原子质量为24,且将0.024千克碳12中所含的碳原子数目定义为阿伏伽德罗常数,则下列物理量数值会变为原来一半的是( )
A.一个碳12原子的质量B.98%硫酸的物质的量浓度
C.标况下气体摩尔体积D.44g干冰所含分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构为下图所示,这种有机物不可能具有的性质是( )
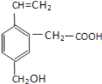
①所有碳原子可能共面;
②能使酸性KMnO4 溶液和溴水褪色,且原理相同;
③1mol 该有机物分别与足量 Na 或NaHCO3 反应,产生气体在标况下体积不相等;
④能发生酯化反应;
⑤能发生加聚反应;
⑥1mol 该有机物完全燃烧生成 CO2 和H2O 消耗 O2 的体积为 280L(标准状况)
A.①②B.②⑥C.③⑥D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某纯碱样品中含有少量氯化钠,现欲测定其碳酸钠的质量分数,设计如下实验方案:
(方案1)称取一定质量的纯碱样品(已知锥形瓶和硫酸溶液的质量190.720 g),利用左图装置测定纯碱样品的纯度,每隔相同时间读得电子天平的数据如表:
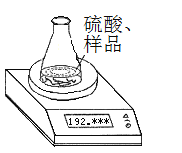
读数次数 | 质量(g) | |
锥形瓶+硫酸+试样 | 第1次 | 192.955 |
第2次 | 192.764 | |
第3次 | 192.328 | |
第4次 | 192.075 | |
第5次 | 192.075 |
(1)计算纯碱样品的纯度时,必需的数据是_____________________________(填具体数据)。不必作第6次读数的原因是________________________________________________。
(2)计算纯碱样品的纯度为_________________________(保留小数后两位)。
(方案2)测定上述样品(1.15 g)中,Na2CO3质量分数的另一种方案,其操作流程如下:
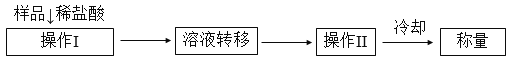
(1)溶液转移至__________(填写仪器名称),操作II的名称是______________。
(2)需直接测定的物理量是____________________。
(3)测定过程中需要的仪器有电子天平.蒸发皿、酒精灯、还需要__________、__________(固定、夹持仪器除外)。
(4)在转移溶液时,如溶液转移不完全,则Na2CO3质量分数的测定结果__________(填“偏小”、“偏大”或“不变”)
(方案3)实验装置如图:
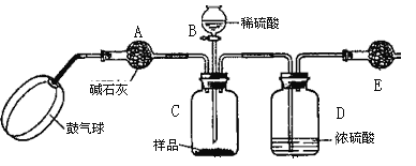
实验步骤:
①如图连接装置并加入所需药品。
②称量并记录E的质量m1(称量时注意封闭E的两端)。
③按动鼓气球,持续约1分钟。
④连接上E。
⑤打开分液漏斗B的活塞,将稀硫酸快速加入C中后,关闭活塞。
⑥按动鼓气球,持续约1分钟。
⑦称量并记录E的质量m2(称量时注意封闭E的两端及D右端的出口)。
⑧重复步骤⑥和⑦的操作,直到球形干燥管的质量基本不变,记为m3。
⑨计算。
请填空和回答问题:
(1)C中发生反应的离子方程式为:______________________________________。B仪器的名称为__________。如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果将__________(填“偏高”、“偏低”或“不变”)。
(2)浓硫酸的作用是_________________,若没有D,则实验结果__________(填“偏高”、“偏低”或“无影响”)。
(3)步骤③和⑥的作用是____________________,____________________。鼓气球的速度是快速好,还是缓慢鼓入?为什么?__________________________________________。
(4)E装置的固体试剂为__________(填编号)
A.碱石灰 B.无水氯化钙 C.浓硫酸 D.生石灰
(5)步骤⑧的目的是________________________________________________。
(6)试样中纯碱样品的质量分数计算式为_____________________________________。
(7)本实验设计中若有需要改进的地方,请指出该进之处并说明原因。
_______________________________________________________________________。
(8)实验还可以用其它定量实验方法测定试样中纯碱的质量分数,请简述一种不同的定量实验方法。___________________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水对自然环境有严重的破坏作用,水污染治理刻不容缓,BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法不正确的是( )

A.该过程中O2-e-=O2-
B.①和②中BMO+和O-都表现较强氧化性
C.催化剂BMO能降低反应的反应热和活化能
D.该过程为放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com