
【题目】NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.0.1molH2和0.1molI2(g)于密闭容器中充分反应,容器内原子总数为0.2NA
B.常温常压下,28gFe和足量浓硝酸混合,转移电子数为1.5NA
C.标准状况下22.4LHF中含有的氟原子数目为NA
D.2gD2O和H2l8O混合物中所含中子数为NA
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】硒(Se)元素是人体必需的微量元素之一。下列说法正确的是
A.硒的摄入量越多对人体健康越好B.SeO32-空间构型为正四面体
C.H2Se的熔沸点比H2S高D.H2SeO4的酸性比H2SO4强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4 L苯含有的分子数约为NA
B.密闭容器中23 g NO2与N2O4的混合气体中氮原子数为0.5NA
C.1 L 0.1 mol·L-1的NaHCO3溶液中,HCO3- 和CO32- 离子数之和为0.1NA
D.密闭容器中1 mol N2(g)与3 mol H2 (g)反应制备氨气,形成6NA个N-H键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以电石主要成分是CaC2)为原料制备乙炔,装置如图所示:
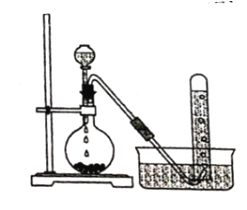
(1)实验室制取乙炔的化学方程式为 ______________。
(2)为除去乙炔中混有的少量硫化氢杂质,可将气体通过 ____________ (选填编号)。
a.酸性KMnO4溶液 b.CCl4 c.NaOH溶液
(3)氧炔焰是乙炔在氧气中燃烧的高温火焰,可用于______________________ 。
(4)乙炔在一定条件下三聚得到CH2=CHC≡CCH=CH2,写出与该三聚物具有相同化学式且不能使溴的CCl4溶液褪色和酸性高锰酸钾溶液褪色的物质的结构简式_________
(5)乙炔聚合得到聚乙炔,聚乙炔__________导电(选填“能”或“不能”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】交联聚合物K合成路线如下(图中表示链延长)
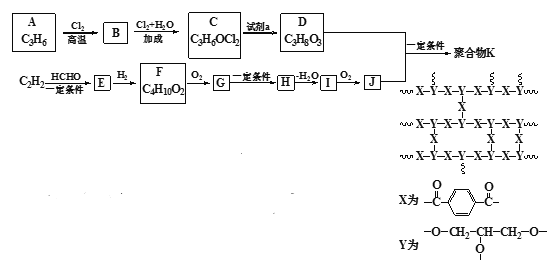
已知: ;
;

(1)按官能团分类,A的类别是__________。
(2)A→B的反应类型是________________。
(3)C可能的结构简式是__________。
(4)C→D所需的试剂a是__________。
(5)C2H2生成E的方程式是__________。
(6)G→H的方程式是__________。
(7)含有苯环,且与I互为同分异构体的酯有_____种。写出其中的一种结构简式___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境治理依然是当今的热点问题。研究相关问题具有重要意义。回答下列问题:
(1)2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g) 快 ΔH1<0
N2O2(g) 快 ΔH1<0
②N2O2(g)+O2(g)![]() 2NO2(g) 慢 ΔH2<0
2NO2(g) 慢 ΔH2<0
反应2NO(g)+O2(g)![]() 2NO2(g)的H=__(用含H1和H2的式子表示)。反应①的活化能E1与反应②的活化能E2的大小关系为E1__E2(填“>”、“<”或“=”)。
2NO2(g)的H=__(用含H1和H2的式子表示)。反应①的活化能E1与反应②的活化能E2的大小关系为E1__E2(填“>”、“<”或“=”)。
(2)工业上常利用CH4来吸收CO2生成CO和H2,再用H2和CO合成甲醇。如在恒容密闭容器中通入物质的量浓度均为1.0mol·L-1的CH4与CO2,在一定条件下仅发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图1所示:
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图1所示:
则:①该反应的ΔH___(填“<”“=”或“>”)0。
②压强p1、p2、p3、p4由大到小的关系为___。判断的理由是______。压强为p4时,在b点:v(正)___(填“<”“=”或“>”)v(逆)。
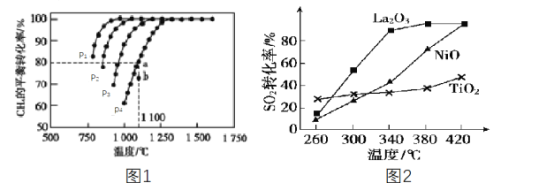
③对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),当p4=0.36MPa,则a点的平衡常数Kp=___(保留3位有效数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)燃煤烟气中硫的回收反应为2CO(g)+SO2(g)=2CO2(g)+S(l)。在其他条件相同、催化剂不同时,硫的回收反应中SO2的转化率随反应温度的变化如图2所示。260℃时,____ (填“La2O3”NiO”或“TiO2”)的催化效率最高。La2O3和NiO作催化剂均可能使SO2的转化率达到很高,不考虑价格因素,选择La2O3的主要优点是__。
(4)该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如图3,写出开始电解时阳极的电极反应式__。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料。实验室可用苯甲醛和乙酸酐、醋酸钠等原料经下列反应制取肉桂酸,其中苯甲醛为无色油状液体。已知:
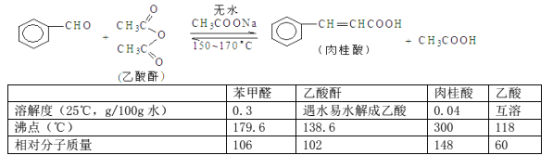
填空:
Ⅰ.合成:反应装置如图所示。向三颈烧瓶中先后加入研细的无水醋酸钠、4.8g苯甲醛和5.6g乙酸酐,振荡使之混合均匀。在150~170℃加热1小时,保持微沸状态。
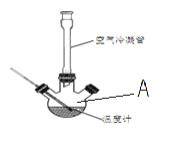
(1)仪器A的名称为___。
(2)空气冷凝管的作用是__,该装置加热要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是__。
(3)不能把无水CH3COONa换成CH3COONa·3H2O的原因是__。
Ⅱ.粗品精制:已知水蒸气蒸馏是分离提纯有机化合物的重要方法之一,可使待提纯的有机物在低于100℃的情况下随水蒸气一起被蒸馏出来,从而达到分离提纯的目的。
将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:
a.在搅拌下,向反应液中加入20mL水
b.再慢慢加入碳酸钠溶液
c.然后进行水蒸气蒸馏
d.待烧瓶内溶液冷却至室温,在搅拌下用加入盐酸酸化,析出大量晶体,过滤,洗涤,干燥。
(4)饱和Na2CO3溶液的作用有__。水蒸气蒸馏可除去的杂质是__;如何判断蒸馏终点___。
(5)若得到的肉桂酸晶体产品不纯,应采用__可得到纯度更高的产品。
(6)若最后得到纯净的肉桂酸5.0g,则该反应中的产率是__(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.甲醇是一种常见的醇,俗称木精或木醇
B.沸点:戊烷>2,2-二甲基戊烷>2,3-二甲基丁烷>丙烷
C.钠融法可以测定有机物的结构
D.木糖醇( ![]() )和葡萄糖互为同系物,均属于糖类
)和葡萄糖互为同系物,均属于糖类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱工业始于 18 世纪末,至今已有两百多年。在纯碱工业史上,比利时人索尔维,中国人侯德榜等都作出了突出的贡献。据此完成下面小题。
【1】下图是1861年索尔维发明的制碱法中物质转化关系图,其中I~IV代表四个主要化学反应,a~i代表除H2O以外不同的物质。若不计其他损耗,,下列说法正确的是( )
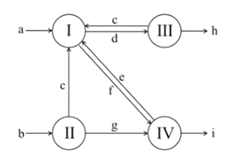
A.水溶液呈碱性的物质只有e、g、h
B.水溶液呈酸性的物质只有c、f、i
C.每消耗1mol a,同时消耗0.5mol b
D.每消耗1mol h,同时消耗0.5mol i
【2】从母液中析出的NaHCO3中含有NH4Cl,需洗涤后再进行灼烧。若省略洗涤操作,则最终对所得纯碱纯度影响叙述正确的是( )
A.无明显影响B.NH4Cl杂质含量上升
C.NaCl杂质含量上升D.NaOH杂质含量上升
【3】化工专家侯德榜发明的"侯氏制碱法"大大推进了纯碱工业的发展,其最重要贡献是( )
A.找到了新型高效的催化剂B.充分利用了能量
C.提高了纯碱产品的纯度D.提升了Na+的利用率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com