
【题目】中和滴定不仅可以测定酸或碱的物质的量浓度,还可以测定某些混合物的含量。
烧碱是重要的化工原料,工业烧碱中可能含有少量NaCl。为测定工业烧碱样品中NaOH的质量分数,进行如下实验:
①称取1. 000g样品,配制成250mL待测液。
②量取20.00mL待测液,用0.1000mol/L标准盐酸溶液滴定。
(1)将1.000g样品配成250mL待测液,所用的玻璃仪器有:烧杯、玻璃棒、胶头滴管 _____________________________________;
(2)量取20.00mL待测液所用的仪器是_______________________;选用的指示剂为_____________________。
(3)滴定操作过程中,眼睛应注视____________________________________________;判断达到滴定终点的依据为_______________________________________________。
(4)第一组学生在测定时,标准盐酸滴过了头,该组学生又加了2.80mL待测液,继续做实验,这种操作__________(填:合理或不合理)。
(5)第二组学生在滴定过程中,不小心将标准液滴在锥形瓶的内壁上,一学生提议用蒸馏水将液滴冲下去,你认为这样操作使结果_______ (填:偏高、偏低或没有影响)。
(6)第三组学生进行了两次滴定,消耗标准盐酸体积的数据如表,其中第2次滴定后滴定管的读数如图所示,将这一读数填入表中。
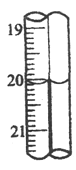
次数 | 滴定前(mL) | 滴定后 |
1 | 0.40 | 20.10 |
2 | 0.10 | ____________ |
该组学生所测得的烧碱样品中NaOH的质量分数为__________________。
【答案】250mL容量瓶 蓝色手柄滴定管或滴定管 甲基橙 锥形瓶内溶液颜色变化 当加入最后1滴盐酸后,黄色变橙色,半分钟内不变回黄色(或不变色) 合理 没有影响 20.00 0.99
【解析】
配制一定物质的量浓度的溶液所需玻璃仪器有:烧杯、玻璃棒、胶头滴管、容量瓶;取碱性溶液时,选用碱式滴定管;滴定过程中,眼睛应注视锥形瓶内溶液颜色的变化;酸碱滴定过程中,可以反滴定;根据滴定过程中所消耗盐酸的物质的量计算出待测液中氢氧化钠的物质的量,得出氢氧化钠的质量,计算出氢氧化钠的质量分数;
(1)配制一定物质的量浓度的溶液250mL,所需玻璃仪器除烧杯、玻璃棒、胶头滴管外,还有250mL容量瓶,故答案为:250mL容量瓶;
(2)待测液为工业烧碱,显碱性,故应选用的仪器为蓝色手柄滴定管或碱式滴定管,选用指示剂甲基橙作为指示剂,故答案为:蓝色手柄滴定管或滴定管;甲基橙;
(3)滴定过程中,眼睛应注视锥形瓶内溶液颜色变化;当加入最后一滴盐酸后,黄色变橙色,半分钟内不变回黄色(或不褪色)为滴定终点,故答案为:锥形瓶内溶液颜色变化;当加入最后1滴盐酸后,黄色变橙色,半分钟内不变回黄色(或不变色);
(4)第一组学生在测定时,标准盐酸滴过了头,该组学生又加了2.80mL待测液,继续做实验,这种操作合理,因为酸碱滴定过程中,可以反滴定;故答案为:合理;
(5)第二组学生在滴定过程中,不小心将标准液滴在锥形瓶的内壁上,用蒸馏水将液滴冲下去,没有影响,故答案为:没有影响;
(6)由图可知,第二次滴定后滴定管的示数为20.00mL,分析上述数据,取滴定1和滴定2的平均值计算,所需盐酸的体积为:
1/2(20.10-0.40+20.00-0.10)mL=19.8mL,1.000gNaOH配制的250mL溶液中的20mL中和盐酸的物质的量为:0.0198L×0.1000mol/L=
0.00198mol,20mLNaOH溶液中含有m(NaOH)=0.00198mol×40g/mol=0.0792g,则250mL溶液中含有NaOH的质量为0.0792g×250mL20mL=0.99g,则氢氧化钠的质量分数=0.99g/1.00g×100%=99%,故答案为:20.00mL;0.99;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有下列各组物质,请按要求填入序号:
A.O2和O3 (臭氧) B.![]() 和
和![]() C.CH3-CH2-CH2-CH3和
C.CH3-CH2-CH2-CH3和![]() D、
D、 和
和 E.甲烷和庚烷
E.甲烷和庚烷
①____________组两物质互为同位素。②____________组两物质互为同素异形体。
③____________组两物质属于同系物。④____________组两物质互为同分异构体。
⑤____________组中的物质是同一物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以电石主要成分是CaC2)为原料制备乙炔,装置如图所示:
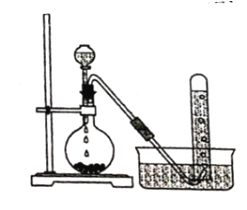
(1)实验室制取乙炔的化学方程式为 ______________。
(2)为除去乙炔中混有的少量硫化氢杂质,可将气体通过 ____________ (选填编号)。
a.酸性KMnO4溶液 b.CCl4 c.NaOH溶液
(3)氧炔焰是乙炔在氧气中燃烧的高温火焰,可用于______________________ 。
(4)乙炔在一定条件下三聚得到CH2=CHC≡CCH=CH2,写出与该三聚物具有相同化学式且不能使溴的CCl4溶液褪色和酸性高锰酸钾溶液褪色的物质的结构简式_________
(5)乙炔聚合得到聚乙炔,聚乙炔__________导电(选填“能”或“不能”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境治理依然是当今的热点问题。研究相关问题具有重要意义。回答下列问题:
(1)2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g) 快 ΔH1<0
N2O2(g) 快 ΔH1<0
②N2O2(g)+O2(g)![]() 2NO2(g) 慢 ΔH2<0
2NO2(g) 慢 ΔH2<0
反应2NO(g)+O2(g)![]() 2NO2(g)的H=__(用含H1和H2的式子表示)。反应①的活化能E1与反应②的活化能E2的大小关系为E1__E2(填“>”、“<”或“=”)。
2NO2(g)的H=__(用含H1和H2的式子表示)。反应①的活化能E1与反应②的活化能E2的大小关系为E1__E2(填“>”、“<”或“=”)。
(2)工业上常利用CH4来吸收CO2生成CO和H2,再用H2和CO合成甲醇。如在恒容密闭容器中通入物质的量浓度均为1.0mol·L-1的CH4与CO2,在一定条件下仅发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图1所示:
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图1所示:
则:①该反应的ΔH___(填“<”“=”或“>”)0。
②压强p1、p2、p3、p4由大到小的关系为___。判断的理由是______。压强为p4时,在b点:v(正)___(填“<”“=”或“>”)v(逆)。
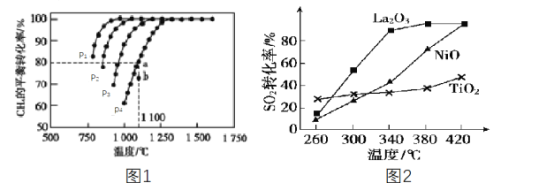
③对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),当p4=0.36MPa,则a点的平衡常数Kp=___(保留3位有效数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)燃煤烟气中硫的回收反应为2CO(g)+SO2(g)=2CO2(g)+S(l)。在其他条件相同、催化剂不同时,硫的回收反应中SO2的转化率随反应温度的变化如图2所示。260℃时,____ (填“La2O3”NiO”或“TiO2”)的催化效率最高。La2O3和NiO作催化剂均可能使SO2的转化率达到很高,不考虑价格因素,选择La2O3的主要优点是__。
(4)该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如图3,写出开始电解时阳极的电极反应式__。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料。实验室可用苯甲醛和乙酸酐、醋酸钠等原料经下列反应制取肉桂酸,其中苯甲醛为无色油状液体。已知:
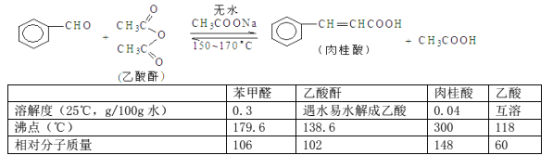
填空:
Ⅰ.合成:反应装置如图所示。向三颈烧瓶中先后加入研细的无水醋酸钠、4.8g苯甲醛和5.6g乙酸酐,振荡使之混合均匀。在150~170℃加热1小时,保持微沸状态。
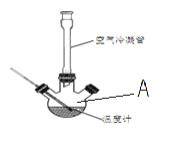
(1)仪器A的名称为___。
(2)空气冷凝管的作用是__,该装置加热要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是__。
(3)不能把无水CH3COONa换成CH3COONa·3H2O的原因是__。
Ⅱ.粗品精制:已知水蒸气蒸馏是分离提纯有机化合物的重要方法之一,可使待提纯的有机物在低于100℃的情况下随水蒸气一起被蒸馏出来,从而达到分离提纯的目的。
将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:
a.在搅拌下,向反应液中加入20mL水
b.再慢慢加入碳酸钠溶液
c.然后进行水蒸气蒸馏
d.待烧瓶内溶液冷却至室温,在搅拌下用加入盐酸酸化,析出大量晶体,过滤,洗涤,干燥。
(4)饱和Na2CO3溶液的作用有__。水蒸气蒸馏可除去的杂质是__;如何判断蒸馏终点___。
(5)若得到的肉桂酸晶体产品不纯,应采用__可得到纯度更高的产品。
(6)若最后得到纯净的肉桂酸5.0g,则该反应中的产率是__(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萝卜硫素(结构如图)是具有抗癌和美容效果的天然产物之一,在一些十字花科植物中含量较丰富。该物质由五种短周期元素构成,其中W、X、Y、Z的原子序数依次增大,Y、Z原子核外最外层电子数相等。下列叙述一定正确的是( )
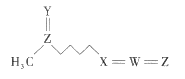
A.原子半径的大小顺序为Z>W>X>Y
B.X的简单氢化物与W的氢化物反应生成离子化合物
C.萝卜硫素中的各元素原子最外层均满足8电子稳定结构
D.Y、Z形成的二元化合物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.甲醇是一种常见的醇,俗称木精或木醇
B.沸点:戊烷>2,2-二甲基戊烷>2,3-二甲基丁烷>丙烷
C.钠融法可以测定有机物的结构
D.木糖醇( ![]() )和葡萄糖互为同系物,均属于糖类
)和葡萄糖互为同系物,均属于糖类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组在实验室用乙醇、浓硫酸和溴化钠和水混合反应来制备溴乙烷,并探究溴乙烷的性质。有关数据见下表:
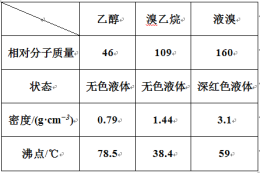
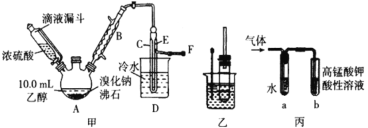
I. 溴乙烷的制备
反应原理如下,实验装置如上图(加热装置、夹持装置均省略):
H2SO4+NaBr ![]() NaHSO4+HBr↑ CH3CH2OH+HBr
NaHSO4+HBr↑ CH3CH2OH+HBr ![]() CH3CH2Br+H2O
CH3CH2Br+H2O
(1) 图甲中A 仪器的名称_____,图中B 冷凝管的作用为_____。
(2) 若图甲中A 加热温度过高或浓硫酸的浓度过大,均会使 C 中收集到的粗产品呈橙色,原因是A 中发生了副反应生成了_____;F 连接导管通入稀NaOH 溶液中,其目的主要是吸收_____等尾气防止污染空气
II. 溴乙烷性质的探究
用如图实验装置验证溴乙烷的性质:
(3) 在乙中试管内加入 10mL6mol·L -1NaOH 溶液和 2mL 溴乙烷,振荡、静置,液体分层,水浴加热。该过程中的化学方程式为_______。
(4) 若将乙中试管里的 NaOH 溶液换成NaOH 乙醇溶液,为证明产物为乙烯,将生成的气体通入如图丙装置。a 试管中的水的作用是_______;若无 a 试管,将生成的气体直接通入 b 试管中,则 b中的试剂可以为 _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了约翰·班尼斯特·古迪纳夫、迈克尔·斯坦利·惠廷汉姆和吉野彰,以表彰他们对锂离子电池研发的贡献。目前最安全的锂离子电池是LiFePO4电池,结构如图所示,电池中间是聚合物的隔膜,只允许Li+通过。
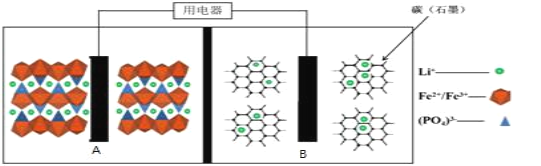
原理如下:(1-x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。
LiFePO4+nC。
下列说法不正确的是( )
A.放电时,B电极发生氧化反应
B.放电时,导线转移1mol电子,B电极室质量减少7xg
C.充电时,A极电极反应式:xLiFePO4-xe-=xFePO4+xLi+
D.充电时,Li+从A电极室向B电极室移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com