
【题目】碱性氢氧燃料电池的总反应方程式为2H2+O2=2H2O,其工作原理如图所示,回答下列问题:

(1)该装置工作过程中,两种主要的能量转化形式为__________、__________。
(2)该电池负极上的电极反应式为__________。
(3)当电路中通过0.2mol电子时,消耗标准状况下的气体b的体积为__________L。
【答案】 化学能→电能 电能→光能 H2-2e-+2OH-=2H2O 1.12
【解析】根据图中给出的电子流动方向可知通气体a的电极有电子流出,极为负极,电极反应为:H2-2e-+2OH-=2H2O;通气体b的电极有电子流入,为正极,电极反应为:O2+ 2H2O +4 e-=4OH-。总反应方程式为2H2+O2=2H2O。
(1)该装置为原电池,原电池是将化学能转化为电能的装置;该装置外接导线连接一个灯泡,可将电能转化为光能;(2) 通气体a的电极有电子流出,极为负极,电极反应为:H2-2e-+2OH-=2H2O;(3) 通气体b的电极有电子流入,为正极,电极反应为:O2+ 2H2O +4 e-=4OH-,当电路中通过0.2mol电子时,会消耗0.05mol转化为标准状况下的体积为0.05mol×22.4L/mol=1.12L。


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】下列实验准备工作正确的是( )
A.将蒸发皿放置在铁架台的铁圈上,并垫石棉网加热
B.固体食盐盛装在细口试剂瓶内
C.结束氢气还原氧化铜的实验时,先熄灭酒精灯后撤出导管
D.将氢氧化钠溶液盛放在试剂瓶内,并用玻璃塞塞紧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着原子序数的递增,下列说法正确的是( )
A.最外层电子数逐渐增多
B.原子半径逐渐减小
C.元素的主要化合价逐渐增加
D.元素的化合价、原子半径、最外层电子数、得失电子能力、金属性与非金属性呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 可用新制的Cu(OH)2悬浊液鉴别乙酸溶液、蔗糖溶液、葡萄糖溶液
B. 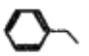 中所有碳原子一定处于同一平面
中所有碳原子一定处于同一平面
C. 苯乙烯、植物油和苯都能与氢气发生加成反应,是因为其结构中都含有碳碳双键
D. 有机物(C4H10)的一溴代物有六种结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,下列药物的主要成分都能发生四种反应的是( )
①取代反应 ②加成反应③水解反应 ④中和.
A.维生素B5: 
B.阿司匹林: 
C.芬必得: 
D.摇头丸: 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉、唾液淀粉酶和控制合成唾液淀粉酶的DNA,它们的基本组成单位依次是 ( )
A. 葡萄糖、葡萄糖和氨基酸 B. 葡萄糖、氨基酸和脱氧核苷酸
C. 麦芽糖、氨基酸和核糖核苷 D. 葡萄糖、氨基酸和核糖核苷酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冰晶石(Na3AlF6)微溶于水。冰晶石主要用作冶炼金属铝的助熔剂,也可用作农作物杀虫剂、制造乳白色玻璃和搪瓷的遮光剂等。工业上用萤石(CaF2含量为96%)、二氧化硅为原料,采用氟硅酸钠法制备冰晶石,其工艺流程如下:

(1)Na3AlF6中Al的化合价为__________,滤渣A的主要成分是__________(填化学式)。
(2)为了提高浸出率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③__________。
(3)根据下表数据,选择“酸浸”时最适合的条件为__________。
实验编号 | 萤石品位 | 硫酸浓度 | 反应温度/℃ | 获得Na2SiF6的质量/g |
1 | 96% | 25% | 60-70 | 120 |
2 | 96% | 35% | 60-70 | 153 |
3 | 96% | 35% | 80-90 | 100 |
4 | 96% | 40% | 60-70 | 141 |
(4)写出反应③的化学方程式__________。
(5)电解熔融Al2O3冶炼铝,化学方程式为![]() ,下图表示一定质量的Al2O3和Na3AlF6固体混合物受热过程中,某变量y随时间的变化趋势。纵坐标表示的是__________。
,下图表示一定质量的Al2O3和Na3AlF6固体混合物受热过程中,某变量y随时间的变化趋势。纵坐标表示的是__________。

A.生成O2的速率 B.固体中Na3AlF6的质量
C.固体中氧元素的质量 D.固体中铝元素的质量分数
(6)此生产工艺的优点为__________(答一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电渗析法可将含硝酸钠的废水再生为硝酸和氢氧化钠,其装置如图所示。

下列叙述不正确的是
A. 膜a、膜c分别是阴离子交换膜、阳离子交换膜
B. 阳极室、阴极室的产品分别是氢氧化钠、硝酸
C. 阳极的电极反应式为2H2O-4e-=4H++O2↑
D. 该装置工作时,电路中每转移0.2 mol 电子,两极共生成气体3.36L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下氢硫酸H2S的电离平衡常数为K1=1.3×10-7,K2=7.1×10-15。下列说法正确的是
A. 在NaHS和Na2S的溶液中都存在c(Na+)+c(H+)=c(HS-)+c(S2-)+c(OH-)
B. 相同温度下,同浓度的NaHS与Na2S溶液的pH比较:前者大于后者
C. 在0.1mol·L-1的NaHS溶液中,存在c(HS-)+c(S2-)=0.1 mol·L-1
D. 向NaHS溶液中加入少量NaOH溶液时,溶液中![]() 、
、![]() 的值均增大
的值均增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com