
【题目】电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
化学式 | HF | H2CO3 | H2S |
电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
(1)已知25℃时,①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-67.7kJ/mol,
②H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,
氢氟酸电离的热化学方程式为________________________。
(2)将浓度为0.1 mol/L HF溶液加水稀释一倍(假设温度不变),下列各量增大的是____。
A.c(H+) B.c(H+)·c(OH-) C.![]() D.
D.![]()
(3)向Na2CO3溶液通入过量H2S,反应的离子方程式为______________。
(4)25℃时,在20mL 0.1mol/L氢氟酸中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____________。
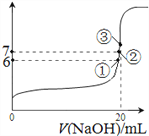
A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(OH-)相等
B.①点时pH=6,此时溶液中, c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)< c(Na+)=0.1mol/L
(5)Na2CO3溶液显碱性是因为CO32-水解的缘故,请设计简单的实验证明之:_______________________。
(6)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F。HFO与水反应得到HF和化合物A,每生成1mol HF转移________mol电子。
(7)已知BiCl3水解产物中有 BiOCl生成。写出水解反应方程式___________________________,为防止其水解,如何配制 BiCl3溶液?_________________________________________________。
【答案】 HF(aq) ![]() H+(aq) +F—(aq) △H=-10.4KJ·mol—1 CD H2S+CO32-==HCO3-+HS- BC 在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅(或其他答案) 1 BiCl3+H2O
H+(aq) +F—(aq) △H=-10.4KJ·mol—1 CD H2S+CO32-==HCO3-+HS- BC 在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅(或其他答案) 1 BiCl3+H2O![]() BiOCl+2HCl 将适量的BiCl3固体溶于少量浓盐酸,再加水稀释
BiOCl+2HCl 将适量的BiCl3固体溶于少量浓盐酸,再加水稀释
【解析】试题分析:由题中数据可知,在相同条件下,各酸的酸性由强到弱的顺序是HF> H2CO3> H2S > HCO3->HS-。
(1)已知25℃时,①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-67.7kJ/mol,②H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol ,由①-②得氢氟酸电离的热化学方程式为HF(aq) ![]() H+(aq) +F—(aq) △H=-10.4KJ·mol—1。
H+(aq) +F—(aq) △H=-10.4KJ·mol—1。
(2)将浓度为0.1 mol/L HF溶液加水稀释一倍(假设温度不变),溶液的酸性减弱, c(H+)减小,水的离子积c(H+)·c(OH-) 不变, ![]() 增大,
增大,![]() 增大,综上所述,各量增大的是CD。
增大,综上所述,各量增大的是CD。
(3)因为酸性H2CO3> H2S > HCO3->HS-,向Na2CO3溶液通入过量H2S,反应的离子方程式为H2S+CO32-==HCO3-+HS-。
(4)25℃时,在20mL 0.1mol/L氢氟酸中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,A. pH=3的HF溶液中水的电离受到酸的抑制,而pH=11的NaF溶液中水的电离程度因盐的水解得到促进,所以,两者由水电离出的c(OH-)不相等,A不正确;B.①点时pH=6,此时溶液中, c(F-)-c(Na+)=c(H+) -c(OH-)=10-6-10-8=9.9×10-7mol/L ,B正确;C.②点时pH=7,c(H+) =c(OH-),由电荷守恒可知,溶液中的c(F-)=c(Na+),C正确;D.③点时V=20mL,酸和碱恰好中和得到氟化钠溶液,氟离子水解,此时溶液中c(F-)< c(Na+)=0.05mol/L,D不正确。综上所述,说法正确的是BC。
(5)Na2CO3溶液显碱性是因为CO32-水解的缘故,只要设法让其水解平衡逆向移动即可证明,所以,可以设计如下简单的实验证明之:在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅。
(6)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F。HFO与水反应得到HF和化合物A,则A为H2O2,HFO中O的化合价由0变为-1(HFO中H为+1价、F为-1价),所以,每生成1mol HF转移1mol电子。
(7)已知BiCl3水解产物中有 BiOCl生成,所以,其水解反应的化学方程式为BiCl3+H2O![]() BiOCl+2HCl。为防止其水解,配制 BiCl3溶液时,将适量的BiCl3固体溶于少量浓盐酸,再加水稀释。
BiOCl+2HCl。为防止其水解,配制 BiCl3溶液时,将适量的BiCl3固体溶于少量浓盐酸,再加水稀释。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,在工农业生产生活中有着重要的应用。某化学兴趣小组同学利用以下装置制备氯气并对氯气的性质进行探究:
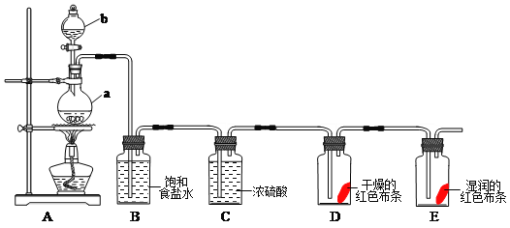
(1)有关氯气、氯水和氯离子的性质,下列说法正确的是_____________
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.Cl-和Cl2都具有很强的氧化性
C.新制氯水可以用来杀菌消毒是因为生成强酸 次氯酸
D.将新制氯水滴入AgNO3溶液,会出现白色沉淀
(2)仪器a的名称为___________,装置B中饱和食盐水的作用是_______________。
(3)装置A中发生反应的离子方程式为:____________________________________。
(4)装置D中的实验现象为__________________,装置E中的实验现象为________
(5)整套实验装置存在着明显缺陷,你的改进措施是__________________________。
(6)8.7gMnO2固体与足量浓盐酸充分反应,在标准状况下产生Cl2的体积为_____L;其中被氧化的HCl的物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1 mol·L-1的NaOH溶液。整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是
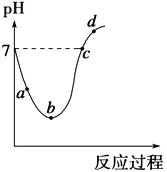
A. 实验进程中水的电离程度:a>c>b
B. 向a点所示溶液中通入SO2,溶液的pH减小,漂白性增强
C. c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO)
D. d点所示的溶液中c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀溶液中含有等物质的量的ZnSO4, Fe2(SO4)3, H2 SO4, CuSO4,向其中逐渐加入铁粉,溶液中Fe2+的物质的量(纵坐标/mol)和加入铁粉的物质的量(横坐标/mol)之间的关系为( )




查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着工农业发展,NH4Cl的需求显著降低,价格低迷和产品积压导致利用“侯氏制碱法”生产的碱厂出现亏损。新联合制碱法在此基础上将氯元素转化为更有应用价值的HCl。

(1)气体X是__________。
(2)已知25℃时部分物质的溶解度数据:
物质 | NaCl | NaHCO3 | NH4Cl | NH4HCO3 |
溶解度/g | 36.0 | 10.3 | 39.5 | 24.8 |
结合表中数据说明过程Ⅰ中的反应能发生的原因是______________。
(3)过程Ⅰ获得的NaHCO3会吸附微量NH4Cl,导致产品Na2CO3中混有NaCl。
①用化学方程式表示过程Ⅱ中NaCl生成的原因:_____________。
②检验Na2CO3中NaCl的实验操作是,取少量固体于试管中_____________。
(4)过程Ⅲ以MgO为催化剂,在不同温度下加热灼烧,将NH4Cl分解为NH3和HCl。

①步骤i中反应的化学方程式是____________。
②过程Ⅲ的优点是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按以下装置图进行实验,填写有关现象及化学方程式。

(1)A中现象是____________________,
(2)B中浓硫酸的作用是_______________
(3)C中发生反应的化学方程式为______________,
(4)D中现象是_______________;反应的离子方程式是__________________________,
E中收集的气体是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置图中的实验方案能达到实验目的的是
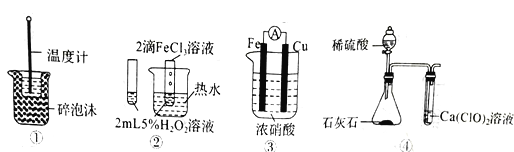
A. 图①可用于中和热的测定
B. 图②可验证FeCl3对H2O2分解反应有催化作用
C. 图③可用于探究铁作负极的原电池原理
D. 图④可用于验证酸性:H2SO4>H2CO3>HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。请回答:

(1)实验室制备氨气的化学方程式为__________。
(2)用装置B收集氨气时,应选择氨气的进气口是_____(选填“a”或“b”),并说明选择的理由是___________。
(3)打开装置B中的止水夹c,若观察到圆底烧瓶内产生了红色喷泉,则说明氨气具有的性质是_________,_________。
(4)为防止污染环境,以下装置(盛放的液体均为水)可用于吸收多余氨气的是_____(填序号)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com