
M2O7x- 和S 2- 离子在酸性溶液中发生如下反应:M2O7x- +3S2-+14H+ =2M3+ +3S↓+7H2O,
则M2O7x- 离子中M元素的化合价是( )
| A.+2 | B.+3 | C.+4 | D.+6 |
科目:高中化学 来源: 题型:单选题
人体血红蛋白中含有Fe2+,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+转变为Fe3+,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有
| A.酸性 | B.碱性 | C.氧化性 | D.还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
阿波罗宇宙飞船以N2H4(联氨)和N2O4为动力源,反应温度达2700℃,反应方程式为:2N2H4+N2O4=3N2+4H2O,关于该反应的说法中正确的是
| A.属于置换反应 | B.联氨是氧化剂 |
| C.联氨是还原剂 | D.氮气是氧化剂,不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
铬是人体必需的微量元素,它与脂类代谢有密切联系,能增强人体内胆固醇的分解和排泄,但铬过量会引起污染,危害人类健康。不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性约为三价铬的100倍。下列叙述错误的是
| A.发生铬中毒时,可服用维生素C缓解毒性,因为维生素C具有还原性 |
| B.K2Cr2O7可以氧化乙醇,该反应可用于检查酒后驾驶 |
| C.在反应Cr2O72-+I-+H+→Cr3++I2+H2O中,氧化产物与还原产物的物质的量之比为3∶2 |
| D.污水中的Cr3+在溶解的氧气的作用下可被氧化为Cr2O72- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知溶液中:还原性: -氧化性
-氧化性 在含有3molNaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法错误的是( )
在含有3molNaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法错误的是( )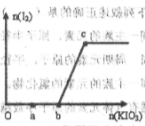
| A.a点时NaHSO3过量 |
| B.b点时还原产物为碘离子 |
| C.b点到c点,KIO3与NaHSO3反应生成单质碘 |
| D.加入的KIO3为0.4mol或1.12mol时,反应后溶液中碘离子均为0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在100m L含等物质的量的HBr和H2SO3的溶液里通入0.025molCl2,有一半Br-变为Br2(已知Br2能氧化H2SO3 )。则原溶液中HBr和H2SO3的浓度都等于( )
| A.0.25mol·L-1 | B.0.002mol·L-1 | C.0.02mol·L-1 | D.0.2mol·L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色(淀粉遇I2变蓝)。下列判断正确的是
| A.上述实验证明氧化性:MnO4->Cl2 > Fe3+ > I2 |
| B.实验①生成的气体不能使湿润的淀粉KI试纸变蓝 |
| C.上述实验中,共有两个氧化还原反应 |
| D.实验②证明Fe2+既有氧化性又有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
实验室可以用高锰酸钾与浓盐酸反应制取氯气,反应的化学方程式如下:
2KMn04+16HCl(浓) = 2KCl+5Cl2↑+2MnCl2+8H20
对于该反应,下列说法正确的是
| A.HCl是氧化剂 | B.是非氧化还原反应 |
| C.反应中锰元素被还原 | D.反应中氢元素的化合价升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com