
【题目】
镁、铜等金属离子是人体内多种酶的辅因子。
(1)Cu位于元素周期表第四周期,铜原子核外电子有____种不同的运动状态,Cu+的核外电子排布式为________。
(2)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴、阳离子个数比为______,该氧化物的电子式为_______________。

(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4H2O,其结构示意图如下,胆矾晶体存在_____化学键,其中SO42-空间构型是______,采用的杂化方式是______。晶体中H、O、S元素电负性由小到大的顺序为_____(用元素符号表示)。

(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
氟化物 | NaF | MgF2 | SiF4 |
熔点/K | 1266 | 1534 | 183 |
解释表中氟化物熔点差异的原因:_____________________________。
(5)金属Mg的堆积方式是六方最密堆积(如左图所示),其晶胞如右图所示镁原子半径为r㎝,阿伏伽德罗常数为NA,则金属镁的晶体密度为______g/㎝3。(用r、NA表达)

【答案】 29 [Ar]3d10 1:1 Cu2+![]() 共价键和配位键离子键 正四面体形 sp3杂化 O>S>H 氟化钠和氟化镁是离子晶体,四氟化硅是分子晶体,一般情况离子晶体熔沸点比分子晶体高。由于Mg2+半径比Na+半径小,Mg2+带电荷比Na+大,氟化镁的晶格能比氟化钠大,所以氟化镁的熔点较高
共价键和配位键离子键 正四面体形 sp3杂化 O>S>H 氟化钠和氟化镁是离子晶体,四氟化硅是分子晶体,一般情况离子晶体熔沸点比分子晶体高。由于Mg2+半径比Na+半径小,Mg2+带电荷比Na+大,氟化镁的晶格能比氟化钠大,所以氟化镁的熔点较高 ![]() g/㎝3
g/㎝3
【解析】 (1)Cu是29号元素,核外电子有29种不同的运动状态的电子,Cu+的核外电子排布式为[Ar]3d10,故答案为:29; [Ar]3d10;
(2)根据均摊法可知,在每个晶胞中含有氧原子数为8×![]() +6×
+6×![]() =4,铜原子数为4,晶胞中阴、阳离子个数比为1:1,化学式为CuO,电子式为
=4,铜原子数为4,晶胞中阴、阳离子个数比为1:1,化学式为CuO,电子式为![]() ,故答案为:1:1;
,故答案为:1:1;![]() ;
;
(3)根据胆矾CuSO4·5H2O结构示意图,胆矾晶体存在共价键、配位键和离子键,其中SO42-中S原子的价层电子对数为4,采用sp3杂化,空间构型为正四面体形;根据元素的非金属性越强,电负性越大,H、O、S元素电负性由小到大的顺序为O>S>H,故答案为:共价键、配位键和离子键;正四面体形;sp3杂化;O>S>H;
(4) 氟化钠和氟化镁是离子晶体,四氟化硅是分子晶体,一般情况离子晶体熔沸点比分子晶体高。由于Mg2+半径比Na+半径小,Mg2+带电荷比Na+大,氟化镁的晶格能比氟化钠大,所以氟化镁的熔点较高,故答案为:氟化钠和氟化镁是离子晶体,四氟化硅是分子晶体,一般情况离子晶体熔沸点比分子晶体高。由于Mg2+半径比Na+半径小,Mg2+带电荷比Na+大,氟化镁的晶格能比氟化钠大,所以氟化镁的熔点较高;
(5)镁原子的半径为rcm,晶胞底面为平行四边形,其各边长为a=2r,所以平行四边形的面积为S=aasin60°=![]() a2,晶胞中平行四面体的h=2×边长为a的四面体的高=2×
a2,晶胞中平行四面体的h=2×边长为a的四面体的高=2×![]() a=
a=![]() a,所以V(晶胞)=S×h=
a,所以V(晶胞)=S×h=![]() a2×
a2×![]() a=
a=![]() a3=8
a3=8![]() r3,
r3,
晶胞中Mg原子个数为1+![]() ×1=2,则金属镁的密度ρ=
×1=2,则金属镁的密度ρ=![]() =
=![]() =
=![]() g/㎝3,故答案为:
g/㎝3,故答案为: ![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应 CH4(g) + H2O(g)==CO(g)+3H2(g) △H1
已知:
①CH4、H2、CO 的燃烧热(△H)分别为-a kJmol-1、-b kJmol-1、-c kJmol-1;
②H2O(l) =H2O(g) △H=+dkJmol-1
则△H1= ___________(用含字母a、b、c、d的代数式表示)kJmol-1。
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如右图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如右图所示,200℃时n(H2)随时间的变化如下表所示:
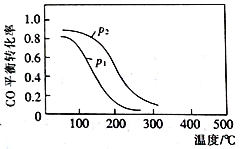
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①△H2_________(填“>”“<”或“ = ”)0。
②写出两条可同时提高反应速率和CO转化率的措施:________________________ 。
③下列说法正确的是____________(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
C.容器内气体压强不再变化时,反应达到最大限度
D.图中压强p12
④03 min内用CH3OH表示的反应速率v(CH3OH)=_________mol L-1·min-1。
⑤200℃时,该反应的平衡常数K =_______。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡____________(填“正向”、“逆向”或“不”)移动。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6 L甲烷,测得电路中转移1.2 mol电子,则甲烷的利用率为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物。则下列说法错误的是

A.常温下,单质a呈气态 B.单质c具有强氧化性
C.稳定性:d>e D.f受热易分解为d和e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双隔膜电解池(两电极均为惰性电极)的结构示意简图如图所示,利用该装置可以电解硫酸钠溶液以制取硫酸和氢氧化钠,并得到氢气和氧气。对该装置及其原理判断错误的是

A. 如电极材料均改为铜板,电解池的总反应方程式不变
B. 向A溶液中滴加石蕊试液显红色
C. c隔膜为阴离子交换膜、d隔膜为阳离子交换膜
D. 相同条件下,c隔膜附近电极产生的a气体与d隔膜附近电极产生的b气体体积比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用10mL 0.1mol/L的BaCl2溶液分别和相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液反应,均恰好使三份溶液中的SO42-离子完全转化为BaSO4沉淀,则三种硫酸盐溶液的物质的量浓度之比是( )
A. 3∶2∶2 B. 1∶2∶3 C. 3∶1∶1 D. 1∶3∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活及生产过程直接排放的超细颗粒物是大气中可吸入颗粒物的主要来源。能减少大气中可吸入颗粒物的措施有( )
A. 加高工厂烟囱 B. 推广使用新能源汽车
C. 安装除尘设备 D. 将高污染产业转型升级
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,HCl作还原剂的是( )
A. NaOH + HCl = NaCl + H2O
B. Zn + 2HCl = ZnCl2 + H2↑
C. MnO2 + 4HCl(浓)![]() MnCl2 + 2H2O + Cl2↑
MnCl2 + 2H2O + Cl2↑
D. CuO + 2HCl = CuCl2 + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:( )
A.有机物CH4有两个π键,2个σ键。
B.分子CO和N2的原子总数相同,价电子总数相等,故性质相似均有毒。
C.Na+的电子排布式为1s22s22p63s1
D.CO2分子的结构按VSEPR模型则一定是直线型。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com