
【题目】草酸亚铁晶体(FeC2O4·xH2O)为淡黄色粉末,不溶于水,可作照相显影剂和用于制药工业。某化学兴趣小组对其性质进行如下探究,回答下列问题:
I.定性探究
选用下列试剂设计实验方案,完成下表内容。
试剂:酸性KMnO4溶液、K3[Fe(CN)6]溶液
操作 | 现象 | 结论与解释 |
(1)取少量草酸亚铁晶体于试管中,加入2mL水,振荡后静置 | 有淡黄色沉淀,上层清液无色 | 草酸亚铁不溶于水 |
(2)继续加入2mL稀硫酸,振荡 | ___________ | 草酸亚铁溶于硫酸,硫酸酸性强于草酸 |
(3)向步骤(2)所得溶液中滴加几滴K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | ___________ |
(4)①___________ | ②___________ | H2C2O4或C2O42-具有还原性 |
Ⅱ.定量探究:滴定实验测x的值
(5)滴定前,下列操作的正确顺序是___________(填字母序号)。
a.用0.1000mol/L的酸性KMnO4溶液润洗
b.查漏、清洗
c.排尽滴定管尖嘴的气泡并调整液面
d.盛装0.1000mol/L的酸性KMnO4溶液
e.初始读数、记录为0.50mL
(6)称取ng样品,加入适量稀硫酸溶解,用步骤(5)准备的标准KMnO4溶液直接滴定,如何判断滴定终点?_______________。
(7)终点读数为20.50mL。结合上述实验数据求得x=___________(用含n的代数式表示,FeC2O4的相对分子质量为144)。
【答案】固体溶解,溶液变为浅绿色 含有Fe2+ 继续滴加K3[Fe(CN)6]溶液(或至不再沉淀),静置,取上层清液滴加酸性KMnO4溶液 紫色褪去 badce 当滴入最后一滴标准液,溶液颜色由浅绿色变成浅紫色,且半分钟内颜色不恢复,则说明达到滴定终点 ![]()
【解析】
Ⅰ.草酸亚铁不溶于水,为淡黄色沉淀,可溶于稀硫酸,溶液变为浅绿色,溶液中滴加几滴K3[Fe(CN)6]溶液,生成蓝色沉淀,滴加酸性高锰酸钾溶液,可发生氧化还原反应;
Ⅱ.(5)滴定时,应先检漏、洗涤、润洗、装液、赶气泡等操作;
(6)高锰酸钾具有氧化性,应用酸式滴定管,与草酸亚铁发生氧化还原反应生成CO2和Fe2(SO4)3;
(7)FeC2O4与酸性高锰酸钾发生氧化还原反应,反应中Fe元素化合价由+2价升高到+3价,C元素化合价由+3价升高到+4价,Mn元素化合价由+7价降低为+2价,则可得反应的关系式为5FeC2O4~3KMnO4,结合关系式计算。
(1)草酸亚铁晶体不溶于水,向其中加入稀硫酸,会看到固体溶解,溶液变为浅绿色;这是由于溶液中含有Fe2+;向该溶液中滴加几滴K3[Fe(CN)6]溶液,会看到产生蓝色沉淀,发生反应:3Fe2++2[Fe(CN)6]=Fe3[Fe(CN)6]2↓,证明该溶液中含有Fe2+;继续滴加K3[Fe(CN)6]2溶液(或至不再沉淀),静置,去上层清液滴加酸性KMnO4溶液,会看到紫色褪色,这是由于溶液中含有的H2C2O4、C2O42-具有还原性,被酸性KMnO4溶液具有氧化性,将微粒氧化为CO2,酸性KMnO4被还原为无色的Mn2+。
(5)滴定前,首先要查漏、清洗;然后用0.1000mol/L的酸性KMnO4溶液润洗;第三是盛装0.1000mol/L的酸性KMnO4溶液,第四排尽滴定管尖嘴的气泡并调整液面;平视凹液面,初始读数、记录为0.50mL,即操作步骤顺序为badce;
(6)称取ng样品,加入适量稀硫酸溶解,用步骤(5)准备的标准KMnO4溶液直接滴定,由于滴定前溶液中含有Fe2+,溶液呈浅绿色,用紫色KMnO4溶液滴定时,Fe2+被MnO4-氧化为Fe3+,MnO4-被还原为无色的Mn2+,所以当滴入最后一滴标准液,溶液颜色由浅绿色变成浅紫色,且半分钟内颜色不恢复,则说明达到滴定终点;
(7)FeC2O4与酸性高锰酸钾发生氧化还原反应,反应中Fe元素化合价由+2价升高到+3价,C元素化合价由+3价升高到+4价,Mn元素化合价由+7价降低为+2价,则可得反应的关系式为5FeC2O4~3KMnO4,反应消耗KMnO4的物质的量为n(KMnO4)=0.1000mol/L×(20.50-0.50)mL×10-3L/mL=0.002mol,则n(FeC2O4)=![]() n(KMnO4)=
n(KMnO4)=![]() mol,根据m=nM可得:
mol,根据m=nM可得:![]() mol×(144+18x)g/mol=ng,解得x=
mol×(144+18x)g/mol=ng,解得x=![]() 。
。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素,它们在周期表中的位置如图所示。下列推断正确的是( )

A. 原子半径:Z>Y>X
B. 元素非金属性:Z>Y>X
C. 最高价氧化物对应水化物的酸性:Z>Y>W
D. WH4与Z元素的单质在光照时发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知固体Na2SO3受热分解生成两种正盐,实验流程和结果如下:
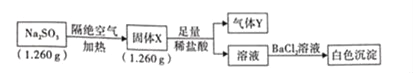
已知:气体Y是一种纯净物,在标准状况下密度为1.518gL﹣1.请回答下列问题:
(1)气体Y的电子式为_____。
(2)实验流程中,Na2SO3受热分解的化学方程式为_____。
(3)另取固体X试样和Na2SO3混合,加适量蒸馏水溶解,再加入稀盐酸,立即有淡黄色沉淀产生。则产生淡黄色沉淀的离子方程式为_____(不考虑空气的影响)。
(4)Na2SO3长期露置在空气中,会被氧化成Na2SO4,检验Na2SO3是否变质的实验操作是_____。
(5)某研究性学习小组通过图所示装置,利用电化学方法处理上述流程中产生的气体Y.基本工艺是将气体Y通入FeCl3,待充分反应后过滤,将所得滤液加入电解槽中进行电解,电解后的滤液可以循环利用。则与a相连的电极反应式为_____。
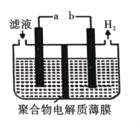
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
X | Y | Z | |
① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
② | NaOH溶液 | SiO2 | 浓盐酸 |
③ | O2 | N2 | H2 |
④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①③B.②④C.①④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯吡格雷是一种用于预防和治疗因血小板高聚集引起的心、脑及其他动脉循环障碍疾病的药物。以2氯苯甲醛为原料合成该药物的路线如下:

(1)A中官能团名称为___________。
(2)C生成D的反应类型为___________。
(3)X( C6H7BrS)的结构简式为____________________________。
(4)写出C聚合成高分子化合物的化学反应方程式:______________________________。
(5)物质G是物质A的同系物,比A多一个碳原子,符合以下条件的G的同分异构体共有___________种。
①除苯环之外无其他环状结构;②能发生银镜反应。
其中核磁共振氢谱中有5个吸收峰,且峰值比为2︰2︰1︰1︰1的结构简式为___________。
(6)已知: 。写出以乙烯、甲醇为有机原料制备化合物
。写出以乙烯、甲醇为有机原料制备化合物![]() 的合成路线(无机物任选)_____________。
的合成路线(无机物任选)_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2 L的密闭容器中加入0.2 mol的N2和0.6 mol的H2在一定条件下发生反应: N2(g) +3H2(g)![]() 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)=___________。平衡时H2的转化率为__________。
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)=___________。平衡时H2的转化率为__________。
(2)平衡后,若提高H2的转化率,可以采取的措施有____________________。
A.加了催化剂
B.增大容器体积
C.降低反应体系的温度
D.加入一定量N2
(3)若在0.5 L的密闭容器中,一定量的氮气和氢气进行如下反应:
N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
T/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1_________________K2(填“<”“>”或“=” );
②下列各项能作为判断该反应达到化学平衡状态的依据是_______(填序号字母)
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B.v(H2)正=3v(N2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应2NH3(g) ![]() N2(g)+3H2(g)的化学平衡常数为_______。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正________v(N2)逆(填“<”“>”或“=”)。
N2(g)+3H2(g)的化学平衡常数为_______。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正________v(N2)逆(填“<”“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下,取不同浓度、不同温度的氨水测定,得到下表实验数据。
温度/℃ | c(NH3·H2O) /(mol·L-1) | 电离常数 | 电离度/% | c(OH-) /(mol·L-1) |
0 | 16.56 | 1.37×10-5 | 9.098 | 1.507×10-2 |
10 | 15.16 | 1.57×10-5 | 10.18 | 1.543×10-2 |
20 | 13.63 | 1.71×10-5 | 11.2 | 1.527×10-2 |
提示:![]()
(1)温度升高,NH3·H2O的电离平衡向________(填“左”或“右”)移动,能支持该结论的表中数据是________(填字母)。
a.电离常数 b.电离度 c.c(OH-) d.c(NH3·H2O)
(2)表中c(OH-)基本不变的原因是__________________________________。
(3)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是_______(填字母,下同)。
A.溶液的pH增大 B.氨水的电离度减小 C.c(OH-)减小 D.c(NH4+)减小
(4)氨水溶液中,下列做法能使c(NH4+)与c(OH-)比值变大的是________。
A.加入固体氯化铵 B.通入少量氯化氢
C.降低溶液温度 D.加入少量固体氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡(SnCl4)是合成有机锡化合物的原料,其熔点为-33℃,沸点为114℃,在潮湿的空气中强烈水解产生有刺激性的白色烟雾,产物之一为SnO2。实验室制备四氯化锡的操作是:将金属锡熔融,然后泼入冷水,制成锡花;将干燥的锡花加入反应器中,再向反应器中缓慢地通入干燥的氯气。(装置C中的试剂Ⅹ未画出)

I.图1为实验室制备干燥氯气的实验装置(夹持装置已略)
(1)该装置制备氯气选用的药品为漂粉精固体[主要成分Ca(ClO2]和浓盐酸,A中发生反应的化学方程式为_________________________________。
(2)装置B中的饱和食盐水能够除去Cl2中的HCl,此外还有___________作用。
(3)试剂Ⅹ可能为___________(填标号)。
A.无水氯化钙 B.浓硫酸 C.五氧化二磷 D.碱石灰
(4)用锡花代替锡粒的目的是_________________________________。
(5)四氯化锡在潮湿空气中水解的化学方程式为_________________________________。
Ⅱ.图2是蒸馏SnCl4的装置
(6)该装置尚有两处不当之处,它们分别是____________________、______________________。
(7)实验用的锡花中含有金属铜。某同学设计下列实验测定锡花的纯度:
第一步:称取7.500g锡花溶于足量稀硫酸中,充分反应后过滤;
第二步:向滤液中加入过量Fe2(SO4)3,将生成的Sn2+氧化成Sn4+;
第三步:用0.9500mol·L-1的K2Cr2O7溶液滴定生成的Fe2+,发生反应的方程式为Fe2++Cr2O72-+H+→Cr3++Fe3++H2O(未配平)
若达到滴定终点时共消耗21.00mLK2Cr2O7溶液,试计算锡花中锡的百分含量:___________(结果保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,燃煤脱硫是科研工作者研究的重要课题之一,主要脱硫方法有以下几种:
Ⅰ.石灰法原理为:2CaO(s)+2SO2(g)+O2(g)2CaSO4(s)
(1)T1℃时,向10L恒容密闭容器中加入3molCaO(s),并通入2molSO2(g)和1molO2(g)发生上述反应,2min时达平衡,此时CaSO4(s)为1.8mol。0~2min内,用SO2(g)表示的该反应的速率v(SO2)=__________________________。
Ⅱ.催化氧化法
活性炭催化氧化法是基于活性良好的物理吸附和化学吸附作用,其反应机理为:
O2+2C→2C—O;SO2+C→C—SO2;C—SO2+C—O→C—SO3+C;
C—SO3+H2O→C—H2SO4;C—H2SO4→H2SO4+C。
(2)整个过程中总的化学反应方程式为__________________________________________。
(3)活性炭在反应过程中作催化剂,改变了_____________(填选项字母)。
A.反应速率 B.反应限度 C.反应焓变 D.反应路径 E.反应活化能
Ⅲ.CO还原法原理为2CO(g)+SO2(g)S(g)+2CO2(g) ΔH
已知:S(g)+O2(g)=SO2(g) ΔH1=-574.0kJ·mol-1;CO燃烧热为283.0kJ·mol-1。
(4)起始温度为T2℃时,分别在三个容积均为10L的绝热密闭容器中,发生反应2CO(g)+SO2(g)S(g)+2CO2(g),测得相关数据如下表所示。
容器 | 起始时物质的量/mol | 平衡时CO2(g)的物质的量/mol | |||
CO(g) | SO2(g) | S(g) | CO2(g) | ||
甲 | 1 | 0.5 | 0.5 | 0 | A |
乙 | 1 | 0.5 | 0 | 0 | 0.8 |
丙 | 2 | 1 | 0 | 0 | b |
①容器乙达到平衡后,保持其他条件不变,再向其中充入CO(g)、 SO2(g)、S(g)、CO2(g)各1mol,此时v(正)__________ v(逆)。(填“>”、“<”或“=”)。
②下列判断正确的是________________(填选项字母)。
A.b=1.6 B.平衡常数甲>乙 C.达到平衡的时间:丙<乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com