
����Ŀ�����ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã��ϳɰ���ҵ�ڹ�������������Ҫ���塣�����ǹ��ںϳɰ����й����⣬��ش�
(1)����һ�ݻ�Ϊ2 L���ܱ������м���0.2 mol��N2��0.6 mol��H2��һ�������·�����Ӧ: N2(g) +3H2(g)![]() 2NH3(g) ��H<0������5����ʱ��Ӧ�ﵽƽ�⣬��ʱ���NH3�����ʵ���Ϊ0.2 mol����ǰ5���ӵ�ƽ����Ӧ����v(N2)=___________��ƽ��ʱH2��ת����Ϊ__________��
2NH3(g) ��H<0������5����ʱ��Ӧ�ﵽƽ�⣬��ʱ���NH3�����ʵ���Ϊ0.2 mol����ǰ5���ӵ�ƽ����Ӧ����v(N2)=___________��ƽ��ʱH2��ת����Ϊ__________��
(2)ƽ��������H2��ת���ʣ����Բ�ȡ�Ĵ�ʩ��____________________��
A.���˴���
B.�����������
C.���ͷ�Ӧ��ϵ���¶�
D.����һ����N2
(3)����0.5 L���ܱ������У�һ�����ĵ����������������·�Ӧ��
N2(g)+3H2(g) ![]() 2NH3(g) ��H<0���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ�����ʾ��
2NH3(g) ��H<0���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ�����ʾ��
T/�� | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
������������⣺
���ԱȽ�K1��K2�Ĵ�С��K1_________________K2������<����>���������� ����
�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������_______���������ĸ��
A.������N2��H2��NH3�����ʵ���Ũ��֮��Ϊ1:3:2
B.v(H2)����3v(N2)��
C.������ѹǿ���ֲ���
D.���������ܶȱ��ֲ���
��400��ʱ����Ӧ2NH3(g) ![]() N2(g)+3H2(g)�Ļ�ѧƽ�ⳣ��Ϊ_______�������NH3��N2��H2���ʵ����ֱ�Ϊ3 mol��2 mol�� 1 molʱ����÷�Ӧ��v(N2)��________v(N2)��������<����>��������������
N2(g)+3H2(g)�Ļ�ѧƽ�ⳣ��Ϊ_______�������NH3��N2��H2���ʵ����ֱ�Ϊ3 mol��2 mol�� 1 molʱ����÷�Ӧ��v(N2)��________v(N2)��������<����>��������������
���𰸡�0.01mol/(L.min) 50% CD �� BC 2 ��
��������
������Ҫ���黯ѧƽ������֪ʶ��
(1)����������÷�Ӧ���ʹ�ʽ![]() ���㰱���ķ�Ӧ���ʣ��ٸ��ݷ�Ӧ����֮�ȵ���ϵ��֮�ȼ���v(N2);����Ũ�ȱ仯��֮�ȵ��ڻ�ѧ������֮��,���㷴�μӷ�Ӧ�����������ʵ���,�ݴ˼���ת������
���㰱���ķ�Ӧ���ʣ��ٸ��ݷ�Ӧ����֮�ȵ���ϵ��֮�ȼ���v(N2);����Ũ�ȱ仯��֮�ȵ��ڻ�ѧ������֮��,���㷴�μӷ�Ӧ�����������ʵ���,�ݴ˼���ת������
(2)ƽ��������H2��ת���ʣ���ƽ�������ƶ���Ӧ��Ӱ��ƽ������ؿ��ǣ���ı�Ũ�ȡ��¶ȡ�ѹǿ�ȣ�
(3)����ƽ��״̬���жϸ����ж�,N2(g)+3H2(g) ![]() 2NH3(g) ��H<0������Ӧ�����������С�ķ��ȷ�Ӧ����ѧƽ�ⳣ��,����Ӧƽ�ⳣ�����淴Ӧ��ƽ�ⳣ����Ϊ����,����Ũ���̺�ƽ�ⳣ���Ĺ�ϵ��ȷ��ƽ����ƶ�������
2NH3(g) ��H<0������Ӧ�����������С�ķ��ȷ�Ӧ����ѧƽ�ⳣ��,����Ӧƽ�ⳣ�����淴Ӧ��ƽ�ⳣ����Ϊ����,����Ũ���̺�ƽ�ⳣ���Ĺ�ϵ��ȷ��ƽ����ƶ�������
(1)5minʱ��Ӧ�ﵽƽ�⣬![]() ,����
,����![]() �����ݷ�Ӧ����֮�ȵ���ϵ��֮��,��ǰ5���ӵ�ƽ����Ӧ����
�����ݷ�Ӧ����֮�ȵ���ϵ��֮��,��ǰ5���ӵ�ƽ����Ӧ����![]() ��5����ʱ��Ӧ�ﵽƽ�⣬���ݷ���ʽN2(g)+3H2(g)
��5����ʱ��Ӧ�ﵽƽ�⣬���ݷ���ʽN2(g)+3H2(g) ![]() 2NH3(g) ��֪����0.2 mol�����������������ʵ���Ϊ0.3mol������������ת����Ϊ0.3mol��0.6mol��100%=50%��
2NH3(g) ��֪����0.2 mol�����������������ʵ���Ϊ0.3mol������������ת����Ϊ0.3mol��0.6mol��100%=50%��
(2)�����H2��ת���ʣ���Ҫƽ�������ƶ�����
A.���������ֻ�ܸı䷴Ӧ���ʣ����ı�ƽ���ƶ�����˲������������ת���ʣ���A���������⣻
B.�÷�Ӧ����Ӧ��һ�����������С�ķ�Ӧ�������������������Сѹǿ��ƽ�������ƶ���������������ת���ʣ���B���������⣻
C.�÷�Ӧ��H<0����Ϊ���ȷ�Ӧ�����ͷ�Ӧ��ϵ���¶ȣ�ƽ�������ƶ��������������ת���ʣ���C�������⣻
D.����һ����N2���ɴٽ�ƽ�������ƶ��������������ת���ʣ���D�������⣻
��������������ӦѡCD��
(3)�ٸ÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ,�����¶�,ƽ�����淴Ӧ�����ƶ�,������Ũ�ȼ�С,��Ӧ��Ũ������,��K1��K2��
�ڷ�ӦN2(g)+3H2(g) ![]() 2NH3(g) ��H<0������Ӧ�����������С�ķ��ȷ�Ӧ,��
2NH3(g) ��H<0������Ӧ�����������С�ķ��ȷ�Ӧ,��
A.ƽ��Ũ��֮�Ⱥ���ʼ���ͱ仯���й�,�����ڸ����ʵ�Ũ��֮�ȵ��ڼ�����֮��,����֤�����淴Ӧ�������,��A����;
B.��ͬ���ʵ����淴Ӧ����֮�ȵ����������֮����ƽ��״̬,v(H2)����3v(N2)����˵�����������淴Ӧ������ͬ����ƽ��״̬,��B��ȷ;
C.��Ӧǰ���������ʵ����仯,��������ѹǿ����,��������ʵ�������,�÷�Ӧ��ƽ��״̬,��C��ȷ;
D.��������ܱ������з�Ӧ,��������,�������,�ܶ�ʼ�ղ���,��D����;
��ˣ�����ӦѡBC��
��400��ʱ,��Ӧ2NH3(g) ![]() N2(g)+3H2(g)�Ļ�ѧƽ�ⳣ��K��ֵ�ͷ�ӦN2(g)+3H2(g)
N2(g)+3H2(g)�Ļ�ѧƽ�ⳣ��K��ֵ�ͷ�ӦN2(g)+3H2(g) ![]() 2NH3(g)��ƽ�ⳣ���ʵ�����ϵ,����K=
2NH3(g)��ƽ�ⳣ���ʵ�����ϵ,����K=![]() =2��
=2��
����NH3��N2��H2���ʵ����ֱ�Ϊ3 mol��2 mol�� 1 molʱ����ʱ��Ũ����![]() ��K=2��˵����Ӧ������У���v(N2)����v(N2)����
��K=2��˵����Ӧ������У���v(N2)����v(N2)����


 ������ҵ����ν�����������ϵ�д�
������ҵ����ν�����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���ӷ�Ӧ���漰H2O��ClO-��NH4+��H+��N2��Cl- �������ӡ�����N2�����ʵ�����ʱ��仯��������ͼ��ʾ�������ж���ȷ����

A. �÷�Ӧ�Ļ�ԭ����Cl-
B. ����1 mol��ԭ����ת��6 mol����
C. �������뻹ԭ�������ʵ���֮��Ϊ2:3
D. ��Ӧ����Һ������������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���������һ�����ڲ�����������ABC�����֣��������������ƶ��������£�A�г���4g������ B�г���16g������C�г���4g������
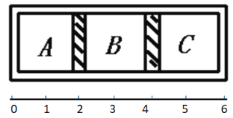
��1�����������ƶ�ʱ����A��B��C�����������VA:VB:VC��____
��2������A��B֮��Ļ�������������������ֻ���õ��ȼ���ָ���ԭ�����¶ȣ�ͨ�����㣬�жϻ���ֹͣ��λ�á������������ֱ�ʾ��____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D��E��F����Ԫ�أ����ǵ������Ϣ���±���
Ԫ�ش��� | �����Ϣ |
A | �����ĵ������Ǵ�����������3�� |
B | ��ˮ�к�����һλ�Ľ���Ԫ�� |
C | L���1�����Ӻ��Ϊ�ȶ��ṹ |
D | ���������Ӻ�����18������ |
E | ʧȥһ�����Ӻ�ͳ�Ϊһ��ԭ�� |
F | ����Ϊ�����к����������� |
����д���пո�
��1��Aԭ�ӵĵ���ʽ��_______________________________��
��2��B���ӵĽṹʾ��ͼ��__________________________����B���������������������ͬ����������____________________________________��д�����֣��������ϱ�ʾ����
��3��CԪ�ص����ƣ�________��Cԭ����������ߵĵ���λ�ڵ�________�㡣
��4��D�Ķ��������ӵĵ���ʽ��___________________________��DԪ�ص�ij��ͬλ��ԭ��������Ϊ34����ԭ�Ӻ��ڵ�������Ϊ______________��
��5��A��E��F����Ԫ������γɶ����������ʣ��������ڹ��ۻ�����Ϊ________�����ӻ�����Ϊ________����д��һ�����ʼ��ɣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������(FeC2O4��xH2O)Ϊ����ɫ��ĩ��������ˮ������������Ӱ����������ҩ��ҵ��ij��ѧ��ȤС��������ʽ�������̽�����ش��������⣺
I.����̽��
ѡ�������Լ����ʵ�鷽��������±����ݡ�
�Լ�������KMnO4��Һ��K3[Fe(CN)6]��Һ
���� | ���� | ��������� |
(1)ȡ�������������������Թ��У�����2mLˮ������ | �е���ɫ�������ϲ���Һ��ɫ | ��������������ˮ |
(2)��������2mLϡ���ᣬ�� | ___________ | ���������������ᣬ��������ǿ�ڲ��� |
(3)����(2)������Һ�еμӼ���K3[Fe(CN)6]��Һ | ������ɫ���� | ___________ |
(4)��___________ | ��___________ | H2C2O4��C2O42�����л�ԭ�� |
��.����̽�����ζ�ʵ���x��ֵ
(5)�ζ�ǰ�����в�������ȷ˳����___________(����ĸ���)��
a.��0.1000mol/L������KMnO4��Һ��ϴ
b.��©����ϴ
c.�ž��ζ��ܼ�������ݲ�����Һ��
d.ʢװ0.1000mol/L������KMnO4��Һ
e.��ʼ��������¼Ϊ0.50mL
(6)��ȡng��Ʒ����������ϡ�����ܽ⣬�ò���(5)���ı�KMnO4��Һֱ�ӵζ�������жϵζ��յ�?_______________��
(7)�յ����Ϊ20.50mL���������ʵ���������x=___________(�ú�n�Ĵ���ʽ��ʾ��FeC2O4����Է�������Ϊ144)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ��һ����
A. H��D��Ϊͬλ�� B. ��ϩ�ͻ����黥Ϊͬ���칹��
C. ̼��![]() ��
�� ![]() ����Ϊͬϵ�� D. ���ʯ��ʯī��C60Ϊͬ��������
����Ϊͬϵ�� D. ���ʯ��ʯī��C60Ϊͬ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ͨ����MnO2��Ũ���ᷴӦ��ȡ�������䷴Ӧ�Ļ�ѧ����ʽΪ��MnO2 + 4HCl(Ũ) ![]() MnCl2 + Cl2��+ 2H2O
MnCl2 + Cl2��+ 2H2O
��1��������������ʾ�÷�Ӧ����ת�Ƶķ������Ŀ��___________��
��2���ڸ÷�Ӧ�У�����1 mol Cl2���ɣ���������HCl�����ʵ�����___________��ת�Ƶ��ӵ���Ŀ��_____________��
��3��ij�¶��£���Cl2ͨ��NaOH��Һ�У���Ӧ�õ�����ClO-��ClO3-���ʵ���֮��Ϊ1��1�Ļ��Һ����Ӧ�Ļ�ѧ����ʽ�� _________________________ ��
��4����ֽ�����˶�����������ϴʱ������ʹ�á�����顱����Ҫ�ɷ������ᣩ�롰84����Һ������Ҫ�ɷ���NaClO�����������ж����¼����Ը�����Ļ�ѧ֪ʶ������ԭ���ǣ������ӷ���ʽ��ʾ��_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪H2S��һ�ֶ�Ԫ���ᣬ�ش��������⣺
��1��0.1mol/L NaHS��Һ�Լ��ԣ���c(S2��)___________c(H2S)������������ ����С���� ���������� �� ��
��2�������£���0.2 mol/L��H2S��Һ����ε���0.2 mol/L NaOH��Һ�����ԣ���ʱ��Һ��������ʾ��ϵһ����ȷ����________��
A��c(H��)��c(OH��)��1��10��14
B��c(Na��)��c(HS��)��2c(S2��)
C��c(Na��) > c(HS��)��c(S2��)+c(H2S)
D��c(H2S) > c(S2��)
��3����֪�����£�CaS������Һ�д���ƽ�⣺CaS(s)![]() Ca2��(aq)��S2��(aq)����H��0��
Ca2��(aq)��S2��(aq)����H��0��
���¶�����ʱ��Ksp________ (����������������С��������������ͬ)��
���μ�����Ũ���ᣬc(Ca2��)________��ԭ����______________________________________________(�����ֺ����ӷ���ʽ˵��)��
��4������CaS����Һ�м���Cu(NO3)2��Һ������һ�ֺ�ɫ�������ʣ�д���ù����з�Ӧ�����ӷ���ʽ___________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ��ͬѹ�£�a g����A��b g����B�ķ�������ͬ������˵���в���ȷ����(����)
A. A��B�����������Է�������֮��Ϊa��b
B. ��ͬ��ͬѹ�������£�A��B����������ܶ�֮��Ϊb��a
C. ͬ������A��B��������ķ��Ӹ���֮��Ϊb��a
D. ��ͬ�����£�ͬ���A������B���������֮��Ϊa��b
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com