
【题目】“煤制油”的关键技术是煤的气化,目前煤的气化主要是煤中的碳和水蒸气反应: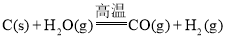 ,该反应是吸热反应,反应所需能量是由间歇进行的碳的燃烧(氧气用空气代替)来提供的:
,该反应是吸热反应,反应所需能量是由间歇进行的碳的燃烧(氧气用空气代替)来提供的: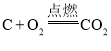 。下列说法不正确的是( )
。下列说法不正确的是( )
A.煤的气化可以减少煤直接燃烧对环境造成的粉尘污染
B.第一个反应需要吸热,所以煤的气化从能量角度来看,得不偿失
C.煤气化后作为燃料,燃烧充分,热利用率高
D.上述两个反应,反应后的混合气体中除去![]() 、
、![]() 后主要是合成氨的两种原料气体
后主要是合成氨的两种原料气体
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是______.
A.使用冷凝管时,应使冷却液与被冷却的物质流动方向相同;
B.盛过苯酚的试管可以用NaOH溶液清洗,若皮肤上沾有苯酚,应立即用酒精洗涤;
C.用![]() 的硫酸和无水乙醇加热至
的硫酸和无水乙醇加热至![]() ,可以制取乙烯;
,可以制取乙烯;
D.除去苯中的少量苯酚,可加入适量的浓溴水后再过滤;
E.分馏原油实验中,温度计的下端不插入原油中;
F.碳化钙是块状固体,但实验室中不用启普发生器制乙炔;
G.将苯与溴水混合后加铁屑可制取溴苯;
H.将溴乙烷与NaOH溶液共热几分钟后冷却,滴入![]() 溶液,观察沉淀颜色,可用来检验溴乙烷中溴元素的存在.
溶液,观察沉淀颜色,可用来检验溴乙烷中溴元素的存在.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿(主要成分为![]() )为原料冶炼金属铝,主要步骤包括:①将粉碎后的铝土矿溶解在氢氧化钠溶液中;②向①的所得溶液中通入过量二氧化碳,获得氢氧化铝固体;③使氢氧化铝脱水生成氧化铝;④……
)为原料冶炼金属铝,主要步骤包括:①将粉碎后的铝土矿溶解在氢氧化钠溶液中;②向①的所得溶液中通入过量二氧化碳,获得氢氧化铝固体;③使氢氧化铝脱水生成氧化铝;④……
(1)步骤④为冶炼金属铝的过程,应选择的方法是______(填序号)。
A.以C、![]() 或
或![]() 作还原剂 B.热分解法 C.利用铝热反应原理还原 D.电解法
作还原剂 B.热分解法 C.利用铝热反应原理还原 D.电解法
(2)步骤③所涉及反应的化学方程式为_____________________________________________。
(3)步骤①所涉及反应的离子方程式为_________________________________________________。
(4)步骤②至步骤③的过程中,须经过_____操作。
(5)步骤②所得溶液中含有的大量阴离子是________________(填离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下进行如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) △>0,达到平衡后,为提高该反应的速率和CO2的转化率,采取的正确措施是( )
CO(g)+H2O(g) △>0,达到平衡后,为提高该反应的速率和CO2的转化率,采取的正确措施是( )
A.加催化剂B.升高温度C.充入CO2D.降低压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放。
(1)用化学方程式表示NO形成硝酸型酸雨的反应______
(2)能作脱除剂的物质很多,下列说法正确的是______
a.用H2O作脱除剂,不利于吸收含氮烟气中的NO
b.用Na2SO3作脱除剂,O2会降低Na2SO3的利用率
c.用CO作脱除剂,会使烟气中NO2的浓度增加
(3)尿素[CO(NH2)2]在一定条件下能有效将NOx转化为N2
Ⅰ.已知可通过下列方法合成尿素:2NH3(g)+CO2(g)![]() H2NCOONH4(s)△H=-159.5kJ/mol
H2NCOONH4(s)△H=-159.5kJ/mol
H2NCOONH4(s)![]() CO(NH2)2(s)+H2O(l) △H=+28.5kJ/mol
CO(NH2)2(s)+H2O(l) △H=+28.5kJ/mol
①尿素释放出NH3的热化学方程式是______。
②写出有利于尿素释放NH3的条件并说明理由______。
ⅡCO(NH2)2与某种烟气![]() 主要为N2、NO和O2)中的NO的物质的量比值分别为1:2、2:1、3:1时,NO脱除率随温度变化的曲线如图:
主要为N2、NO和O2)中的NO的物质的量比值分别为1:2、2:1、3:1时,NO脱除率随温度变化的曲线如图:
①曲线a对应CO(NH2)2与NO的物质的量比值是______。
②曲线a、b、c中,800℃~900℃区间内发生主要反应的化学方程式是______。
③900℃~1200℃区间内脱除率下降,NO浓度上升,发生的主要反应是______。
④曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为______mg/(m3·s) 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)已知在448℃时,反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K1为49,则该温度下反应
2HI(g)的平衡常数K1为49,则该温度下反应![]() H2(g)+
H2(g)+![]() I2(g)
I2(g)![]() HI(g)的平衡常数K2为____________。
HI(g)的平衡常数K2为____________。
(II)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应为________(填“吸热”或“放热”)反应。
(3)能判断该反应达到化学平衡状态的依据是________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。
(5)在800℃时,发生上述反应,某时刻测得容器内各物质的浓度分别为c(CO2)为2mol·L-1,c(H2)为1.5mol·L-1,c(CO)为1mol·L-1,c(H2O)为3mol·L-1,则下一时刻,反应将________(填“正向”或“逆向”)进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下表为![]() 时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
| HClO |
|
|
|
|
A.向NaClO溶液中通入少量二氧化碳的离子方程式为:![]()
B.相同浓度的![]() 和NaClO的混合溶液中,
和NaClO的混合溶液中,![]()
C.向![]() 溶液中加入少量水,溶液中pH增大
溶液中加入少量水,溶液中pH增大
D.25℃时,![]() 溶液通入
溶液通入![]() 至溶液的
至溶液的![]() 时,溶液中:
时,溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为二元弱酸,
为二元弱酸,![]() ,
,![]() ,设
,设![]() 溶液中
溶液中![]() 。室温下用NaOH溶液滴定
。室温下用NaOH溶液滴定![]() 溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )
溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )
A.![]() 溶液:
溶液:![]()
B.![]() 的溶液:
的溶液:![]()
C.![]() 的溶液:
的溶液:![]()
D.![]() 的溶液:
的溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物醇A与羧酸B发生酯化反应生成分子式为C9H18O2的酯,0.5molA完全燃烧产生的气体被足量的澄清石灰水吸收生成200g沉淀,则下列说法正确的是( )
A.A的分子式为C4H8OB.B的分子式为C5H10O2
C.酯C9H18O2在稀硫酸溶液中不水解D.有机物A、B都能与NaHCO3溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com