
【题目】锂离子二次电池正极材料磷酸亚铁锂是应用广泛的正极材料之一。一种制备磷酸亚铁锂的化学方法为:C+4FePO4+2Li2CO3![]() 4LiFePO4+3CO2↑.回答下列问题:
4LiFePO4+3CO2↑.回答下列问题:
(1)Fe失去电子变成为阳离子时首先失去______轨道的电子。
(2)C、O、Li原子的第一电离能由大到小的顺序是______;PO43-的空间构型为______。
(3)C与Si同主族,CO2在高温高压下所形成的晶体结构与SiO2相似,该晶体的熔点比SiO2晶体______(填“高”或“低”)。硅酸盐和SiO2一样,都是以硅氧四面体作为基本结构单元,下图表示一种含n个硅原子的单链式多硅酸根的结构(投影如图1所示),Si原子的杂化类型为______,其化学式可表示为______。

(4)图2表示普鲁士蓝的晶体结构(![]() 个晶胞,K+未标出,每隔一个立方体在立方体体心有一个钾离子)。
个晶胞,K+未标出,每隔一个立方体在立方体体心有一个钾离子)。
①普鲁士蓝晶体中每个Fe3+周围最近且等距离的Fe2+数目为______个。
②晶体中该立方体的边长为a nm,设阿伏加德罗常数为NA,其晶体密度为______gcm-3。
【答案】4s O>C>Li 正四面体 高 sp3 (SiO3)n2n- 6 ![]()
【解析】
(1)失电子先从最外层失去;
(2)同周期主族元素,随着原子序数增大,电负性增强,根据VSEPR理论判断PO43-的空间构型;
(3)CO2在高温高压下所形成的晶体结构与SiO2相似,C的半径小于Si,[SiO4]中Si的价层电子对数为4,根据均摊原理计算化学式;
(4)①根据晶体结构,Fe3+周围的Fe2+离子在顶点上;
②根据![]() 晶胞计算1个整晶胞的质量,再由密度公式
晶胞计算1个整晶胞的质量,再由密度公式![]() 计算晶体密度。
计算晶体密度。
(1)Fe的基态核外电子排布为:[Ar]3d64s2,失电子先从最外层失去,所以先失去4s2电子;
故答案为:4s;
(2)同周期主族元素,随着原子序数增大,电负性增强,所以C、O、Li原子的第一电离能由大到小的顺序是:O>C>Li;对于PO43-,根据VSEPR理论,VP=BP+LP=4+![]() =4,则其空间构型为正四面体;
=4,则其空间构型为正四面体;
故答案为:O>C>Li;正四面体;
(3)CO2在高温高压下所形成的晶体结构与SiO2相似,C的半径小于Si,所以C-O之间的作用力比Si-O之间作用力强,熔点更高,[SiO4]中Si的价层电子对数为4,所以Si原子的杂化类型为sp3;根据均摊原理,一个基本单元中含有1个Si,O的数目为2+2×![]() =3个,一个基本单元所带电荷为2-,则其化学式可表示为:(SiO3)n2n-;
=3个,一个基本单元所带电荷为2-,则其化学式可表示为:(SiO3)n2n-;
故答案为:高;sp3;(SiO3)n2n-;
(4)①根据晶体结构,Fe3+周围的Fe2+离子在顶点上,以其中一个顶点的Fe3+来看,由于晶胞的无隙并置,该Fe3+所在晶胞内有等距最近的Fe2+3个,这3个相当于分别存在三条坐标轴半轴上,则每个Fe3+周围最近且等距离的Fe2+数目为2×3=6个;
故答案为:6;
②取1mol晶胞,则1mol晶胞质量为m=8×(8×![]() ×56+12×
×56+12×![]() ×26)+4×39g=1228g,1mol晶胞即有NA个晶胞,1个整晶胞体积为V=(2a)3×10-21cm3,所以晶体密度为
×26)+4×39g=1228g,1mol晶胞即有NA个晶胞,1个整晶胞体积为V=(2a)3×10-21cm3,所以晶体密度为![]() =
=![]() g/cm3=
g/cm3=![]() g/cm3;
g/cm3;
故答案为:![]() 。
。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】将一定质量的钠、钾分别投入盛有相同浓度和体积的盐酸![]() 盐酸过量
盐酸过量![]() 的两个烧杯中,产生的气体的质量随时间变化曲线如图所示,则下列说法正确的是
的两个烧杯中,产生的气体的质量随时间变化曲线如图所示,则下列说法正确的是![]()
![]()
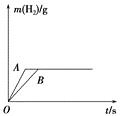
A.投入的Na、K的质量一定相等
B.投入的Na的质量大于K的质量
C.曲线A表示Na与盐酸反应,曲线B表示K与盐酸反应
D.该实验能证明K的金属性比钠的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z和W四种元素.已知:①![]() 、Y、Z属同一短周期,其离子以
、Y、Z属同一短周期,其离子以![]() 、
、![]() 、
、![]() 的形式存在。②
的形式存在。②![]() 和Z组成化合物
和Z组成化合物![]() 溶液遇苯酚呈紫色。请回答:
溶液遇苯酚呈紫色。请回答:
(1)Z的最高价氧化物对应水化物的名称为 ______
(2)X的单质在二氧化碳中燃烧的化学方程式为 ______
(3)Y的单质可用于冶炼金属锰,写出Y与二氧化锰反应的化学方程式 ______,Y的最高价氧化物对应的水化物既可溶于强酸又可溶于强碱,请用电离平衡理论解释其原因______
(4)当有![]() W组成的单质,在加热条件下与足量水完全反应,则生成气体标准状况下的体积为 ______ L
W组成的单质,在加热条件下与足量水完全反应,则生成气体标准状况下的体积为 ______ L
(5)我国陆地上冶炼X的主要流程如图所示:
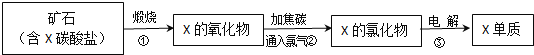 已知当有lmolX的氧化物参加反应时,有2mol电子转移且生成三种产物,则步骤②反应的化学方程式为 ______
已知当有lmolX的氧化物参加反应时,有2mol电子转移且生成三种产物,则步骤②反应的化学方程式为 ______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C12能与过量的NH3反应得到一种固体M和单质H.下列说法正确的是( )
A.M中含离子键、共价键、配位键B.NH3的电子式为![]()
C.H中σ键与π百键个数比为1:1D.NH3和Cl2都属于极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染等方面应用广泛。利用SO2生产Na2S2O5的工艺如图:
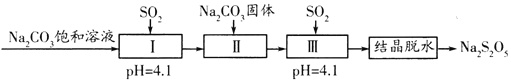
资料:Na2S2O5通常是由NaHSO3过饱和溶液经结晶脱水制得,下列说法正确的是( )
A.Na2S2O5是Na2SO3和SO2的混合物
B.pH=4.1时,I中主要反应的化学方程式为Na2CO3+SO2=Na2SO3+CO2
C.加入Na2CO3固体的目的是调节pH,促进Ⅲ中SO2的再吸收
D.“结晶脱水”过程中反应的化学方程式为2NaHSO3=Na2S2O5+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池的装置如图所示,总反应为 H2(g)+HgO(s)=H2O(1)+Hg(1),其中阴离子交换膜只允许阴离子和水分子通过。下列说法正确的是 ( )
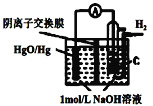
A.正极反应为:HgO(s)2e+H2O=Hg(l)+2OH
B.放电结束后,溶液的碱性不变
C.OH通过离子交换膜从负极向正极移动,保持溶液中电荷平衡
D.每反应 2.24 L(标准状况下)氢气,交换膜通过 0.2 mol 离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸香叶酯是一种食品香料,可由香叶醇与甲酸发生酯化反应制得。下列说法正确的是( )
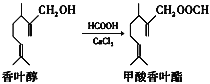
A.香叶醇的分子式为C11H18O
B.香叶醇在浓硫酸、加热条件下可发生消去反应
C.1 mol甲酸香叶酯可以与3 mol H2发生加成反应
D.甲酸香叶酯与新制的Cu(OH)2悬浊液共热可生成红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定人体血液中Ca2+的含量,设计了如下方案:
![]()
有关反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4 K2SO4+2MnSO4+10CO2↑+8H2O若血液样品为15mL,滴定生成的草酸消耗了0.001mol·L-1的KMnO4溶液15.0mL,则这种血液样品中的含钙量为
A.0.001mol·L-1B.0.0025mol·L-1 C.0.0003mol·L-1D.0.0035mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气的主要成分是甲烷,含有少量的羰基硫![]() 、乙硫醇
、乙硫醇![]() 等气体。
等气体。
(1)组成羰基硫的元素中,原子半径最小的元素在周期表中的位置是 ______。
(2)乙硫醇有特殊气味,是天然气的臭味指示剂.乙硫醇可以看作是乙醇分子中羟基![]() 被
被![]() 取代,则乙硫醇的结构式为 ______。
取代,则乙硫醇的结构式为 ______。
(3)下列事实可用于比较C与S两种元素非金属性![]() 原子得电子能力
原子得电子能力![]() 相对强弱的是 ______ (填序号)。
相对强弱的是 ______ (填序号)。
a.沸点:![]()
![]() 元素在周期表中的位置
元素在周期表中的位置 ![]() 酸性:
酸性:![]()
![]() 同温同浓度水溶液的pH:
同温同浓度水溶液的pH:![]()
(4)羰基硫水解及利用的过程如下![]() 部分产物已略去
部分产物已略去![]() :
:![]() 溶液
溶液![]() 溶液
溶液![]()
①常温下,在反应Ⅱ中,每吸收![]() 气体放出热量a kJ,其热化学方程式为 ______。
气体放出热量a kJ,其热化学方程式为 ______。
②已知X溶液中硫元素的主要存在形式为![]() ,则反应Ⅲ中生成该离子的离子方程式为 ______。
,则反应Ⅲ中生成该离子的离子方程式为 ______。
③如图是反应Ⅲ中,在不同反应温度下,反应时间与![]() 产量的关系图
产量的关系图![]() 初始含量为
初始含量为![]() 请结合图象数据解释X溶液中除
请结合图象数据解释X溶液中除![]() 外,还有
外,还有![]() 、
、![]() 的原因______。
的原因______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com