
【题目】常温下,向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液,混合溶液的pH随KOH溶液的加入变化情况如图,下列结论错误的是( )
溶液,混合溶液的pH随KOH溶液的加入变化情况如图,下列结论错误的是( )

A.当加入![]() mLKOH溶液时,所得溶液中水的电离程度大于X点溶液的水的电离程度
mLKOH溶液时,所得溶液中水的电离程度大于X点溶液的水的电离程度
B.HA为弱酸,常温下,Ka的数量级为![]()
C.Y点对应的溶液中:![]()
D.若用KOH溶液滴定HA溶液,可选用甲基橙作指示剂
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。磷酸铁锂锂离子电池充电时阳极反应式为,![]() ,放电工作示意图如图。下列叙述不正确的是
,放电工作示意图如图。下列叙述不正确的是

A.放电时,Li+通过隔膜移向正极
B.放电时,电子由铝箔沿导线流向铜箔
C.放电时正极反应为:![]()
D.磷酸铁锂锂离子电池充放电过程通过Li+迁移实现,C、Fe、P元素化合价均不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用![]() 溶液滴定
溶液滴定![]() 溶液,曲线如图所示。下列说法错误的是
溶液,曲线如图所示。下列说法错误的是
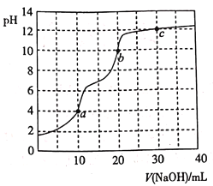
A.滴定终点a可选择甲基橙作指示剂
B.c点溶液中![]()
C.b点溶液中![]()
D.a、b、c三点中水的电离程度最大的是c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在pH=5的CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
A.加入水时,平衡向右移动,CH3COOH电离常数增大
B.加入少量CH3COONa固体,平衡向右移动
C.加入少量NaOH固体,平衡向右移动,c(H+)减小
D.加入少量pH=5的硫酸,溶液中c(H+)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的![]() ,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用
,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用![]() 外,还能得到一种复合肥料。
外,还能得到一种复合肥料。
(1)①若氨水与![]() 恰好完全反应生成正盐,则此时溶液呈________性
恰好完全反应生成正盐,则此时溶液呈________性![]() 填“酸”或“碱”
填“酸”或“碱”![]() 。常温下弱电解质的电离平衡常数如下:氨水
。常温下弱电解质的电离平衡常数如下:氨水![]()
![]() 溶液中通入________气体可使溶液呈中性。
溶液中通入________气体可使溶液呈中性。![]() 填“
填“![]() ”或
”或![]() ”
”![]() 此时溶液中
此时溶液中![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]()
(2)向![]() 溶液通入过量
溶液通入过量![]() ,充分反应后所得溶液中离子浓度大小顺序为________________。
,充分反应后所得溶液中离子浓度大小顺序为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol·L-1的氨水加水稀释至0.01 mol·L-1,稀释过程中温度不变,下列叙述正确的是( )
A.稀释后溶液中c(H+)和c(OH-)均减小
B.稀释后溶液中c(OH-)变为稀释前的1/10
C.稀释过程中氨水的电离平衡向左移动
D.稀释过程中溶液中 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能用勒夏特列原理解释的是
A. 工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B. H2、I2(g)混合气体加压后颜色变深
C. 红棕色的NO2加压后颜色先变深再变浅
D. 实验室用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将0.10 mol·L-1氨水加水稀释后,溶液中c(![]() )·c(OH-)变大
)·c(OH-)变大
B.为确定某酸H2A是强酸还是弱酸,可测H2A溶液与H2SO4溶液的导电性。若导电性比硫酸弱,则H2A是弱酸。
C.将CH3COOH溶液加水稀释后,溶液中 变大
变大
D.用0.200 0 mol·L-1NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合溶液中两种酸的浓度均为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com