
����Ŀ�������йؼ���ķ�����ȷ����
A. ij��Һ100 mL�����к�����0.03 mol������0.04 mol�����ڸ���Һ��Ͷ��1.92 gͭ���ȣ���Ӧ��ų�һ����������ԼΪ0.015 mol
B. ����ʱ�����ݻ�Ϊa mL���Թ��г���NO2���壬Ȼ������ˮ�е�����ˮ�治������ʱΪֹ����ͨ��b mL O2�������Һ���ּ�������������Թ������ʣ������Ϊc mL���Ҹ����岻��֧��ȼ�գ���a��b�Ĺ�ϵ��a��4b��c
C. ��ӦKClO4��8HCl===KCl��4Cl2����4H2O�У�ÿ����4 mol Cl2ת�Ƶĵ�����Ϊ8NA
D. ���������������ϡ���ᷴӦ�Ļ�ѧ����ʽΪ��Fe3O4��HNO3(ϡ) ![]() Fe(NO3)3��NO����H2O(δ��ƽ)23.2 g������������ȫ�ܽ���ϡ�����У�ת��0.1 mol����
Fe(NO3)3��NO����H2O(δ��ƽ)23.2 g������������ȫ�ܽ���ϡ�����У�ת��0.1 mol����
���𰸡�D
��������ͭ��ϡ���ᷴӦ��ʵ����3Cu+8H++2NO3-=3Cu2++2NO��+4H2O,����Һ��ÿ3molCu��8molH+��ȫ��Ӧ����2molNO����,���л����Һ�к�H+�����������к�0.06mol,�����к�0.04mol,������Һ�й���0.1molH+,1.92gͭ�����ʵ���Ϊ0.03mol,�������ӷ���ʽ���Ĺ�ϵ,![]() ,�����ӹ���,ͭ������ȫ��Ӧ,���ɵ�NO������ͭ�����ʵ�������ó�,�������ʵ���Ϊ0.02mol,A�����ݷ�Ӧ3NO2+H2O=2HNO3+NO, amLNO2������a/3mLNO ,ͨ��O2��,������岻֧��ȼ��,��cLΪNO,����b mLO2��Ӧ��NOΪ(a/3-c)mL,���ݷ���ʽ:4NO+3O2+2H2O=4HNO3,��(a/3-c):b=4:3,�����ɵ�a=4b+3c��B����ӦKClO4��8HCl===KCl��4Cl2����4H2O�У�KClO4��+7���Ƚ��͵�0���ȣ�1mol KClO4��ȫ��Ӧ��ת��7mol���ӣ���7NA��C�����������������ϡ���ᷴӦ�Ļ�ѧ����ʽΪ��3Fe3O4��28HNO3(ϡ)===9Fe(NO3)3��NO����14H2O��3molFe3O4��ȫ��Ӧת��3mol���ӣ���23.2gFe3O4(0.1 mol)��ȫ��Ӧת��0.1 mol���ӣ�D��ȷ����ȷѡ��D��
,�����ӹ���,ͭ������ȫ��Ӧ,���ɵ�NO������ͭ�����ʵ�������ó�,�������ʵ���Ϊ0.02mol,A�����ݷ�Ӧ3NO2+H2O=2HNO3+NO, amLNO2������a/3mLNO ,ͨ��O2��,������岻֧��ȼ��,��cLΪNO,����b mLO2��Ӧ��NOΪ(a/3-c)mL,���ݷ���ʽ:4NO+3O2+2H2O=4HNO3,��(a/3-c):b=4:3,�����ɵ�a=4b+3c��B����ӦKClO4��8HCl===KCl��4Cl2����4H2O�У�KClO4��+7���Ƚ��͵�0���ȣ�1mol KClO4��ȫ��Ӧ��ת��7mol���ӣ���7NA��C�����������������ϡ���ᷴӦ�Ļ�ѧ����ʽΪ��3Fe3O4��28HNO3(ϡ)===9Fe(NO3)3��NO����14H2O��3molFe3O4��ȫ��Ӧת��3mol���ӣ���23.2gFe3O4(0.1 mol)��ȫ��Ӧת��0.1 mol���ӣ�D��ȷ����ȷѡ��D��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̽��������������ʵĹ�����,���и���ʵ������ó��Ľ��۲���ȷ����( )
A. �����а������Թܵ�����ˮ����,Һ��Ѹ�ٳ����Թ�,˵��������������ˮ
B. ��pH=11�İ�ˮϡ��1000��,���pH>8��˵��NH3��H2OΪ����
C. ����NH4HCO3����,�۲쵽��������,�Թܿ���Һ�β���,˵��NH4HCO3���Ȳ��ȶ�
D. �����ȵ�Pt˿������ͼ��ʾ����ƿ��,ƿ�ڳ�����������ɫ����,˵����������������ΪNO2

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʾΪԪ�����ڱ���һ���֣�����Ԫ����~���ڱ��е�λ�ã���ش���������:
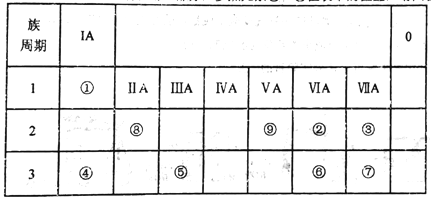
��1��������������ԭ�Ӱ뾶�ɴ�С��˳����___________(��Ԫ�ط��ű�ʾ)��
��2��������ʵ��˵����Ԫ�صķǽ����ԱȢ�Ԫ�صķǽ�����ǿ����_______��
A.���ĵ�������Ԫ�صļ��⻯����Һ��Ӧ����Һ�����
B.��������ԭ��Ӧ�У�1mol�����ʱ�lmo1�����ʵõ��Ӷ�
C.��������Ԫ�صļ��⻯�����ȷֽ⣬ǰ�ߵķֽ��¶ȸߡ�
��3������������Ԫ�ذ�ԭ�Ӹ���֮��Ϊ1��1��ɵij���Һ̬�������������Һ���ܽ�Fe2+������д���÷�Ӧ�����ӷ���ʽ____________________��
��4����֪���ڱ��д��ڶԽ����ƹ�������(Be)������ѧ�������ƣ������������������Ҳ�����ԣ�д������������������������������ˮ���ﷴӦ�Ļ�ѧ����ʽ_____________��
��5����֪W+X=Y+Z (��Ӧ��Ҫ���ȣ�)��W��X��Y��Z�ֱ������٢ڢ�����Ԫ���γɵ�����10����������W��XΪ���ӣ�Y��ZΪ����)��д���û�ѧ����ʽ______________��
��6���ɱ���Ԫ���γɵ����ʿɷ�����ͼ�еķ�Ӧ������B��C��G�ǵ��ʣ�BΪ����ɫ���壬D��Һ�Լ��ԡ�
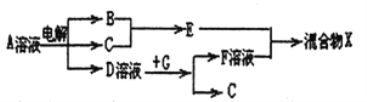
��д��D��Һ��G��Ӧ�����ӷ���ʽ_______________��
��д������A��Һ�����ʵ������ӵķ���_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�ͽ������ķ�����
A. �۲���� B. �����ЧӦ C. �����˶� D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧԭ���ڿ��к��������й㷺Ӧ�á�
��1�����������Ƚ���(��Ҫ�ɷ�ΪCO��CH4��H2)��SO2��һ�������»�ԭΪ�������������������֪��
��C(s)+O2(g)=CO2(g) ��H1=-393.5 kJ��mol-1
��CO2(g)+C(s)=2CO(g) ��H2= + 172.5 kJ��mol-1
��S(s)+O2(g)=SO2(g) ��H3=- 296.0 kJ��mol-1
CO��SO2 ��ԭΪ��������Ȼ�ѧ����ʽΪ_____________________________________��
��2��CO�����ںϳɼ״���һ���¶��£������Ϊ2 L���ܱ������м���CO��H2��������ӦCO(g)+2H2(g)![]() CH3OH(g)���ﵽƽ����ø���ֵ�Ũ��������
CH3OH(g)���ﵽƽ����ø���ֵ�Ũ��������
���� | CO | H2 | CH3OH |
Ũ�ȣ�mol��L-1�� | 0.9 | 1.0 | 0.6 |
����Ӧ�ﵽƽ��ʱ��CO��ת����Ϊ_______________��
���÷�Ӧ��ƽ�ⳣ��K=________________��
�����º��������£�����˵����Ӧ�Ѵﵽƽ��״̬����__________(����)��
A��v��(CO)=2v��(H2) B�����������ܶȲ���
C����������ƽ����Է����������� D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
�������������ѹ����1L����ﵽ��ƽ��ʱc(H2)��ȡֵ��Χ��_____________��
������������������䣬�ٳ���0.6molCO��0.4molCH3OH����ʱv��__________v��(����>��<������=��)��
��3����������HNO2�ĵ��볣��Ka=7.1��10-4mol��L-1��NH3��H2O�ĵ��볣��Kb=1.7��10-5mol��L-1��0.1mol��L-1NH4NO2��Һ������Ũ���ɴ�С��˳����__________��������NO2-ˮ�ⷴӦ��ƽ�ⳣ��Kb=__________(������λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ӫ���ḻ���������ʡ����ۡ���֬��Ҷ�ᡢά����C��Ҷ���أ�Ӫ���ɷ�λ��ͬ���߲�֮�ף�����Ϊ���߲˻ʹڡ��� ��ά����C����Ϊ �� ��һ֧ʢ��2mL 2%������Һ���Թ��е���2�ε�ˮ����Һ����ɫ���ٵ���ά����C��ˮ��Һ����Һ��ɫ��Ϊ �� ��ʵ��˵��ά����C�����ԣ�
����֬��������ˮ������ղ�������д���ƣ����ͣ�
���������ɷ��п�����Ȼ��ɫ������ �� ����������� �� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǽ���þ��±�ص���(X2)��Ӧ�������仯ʾ��ͼ��

����˵����ȷ����
A. ±�ص���(X2)��ˮ��Ӧ��������������
B. �õ���ʽ��ʾMgF2���γɹ���Ϊ�� ![]()
C. ���ȶ��ԣ�MgI2��MgBr2��MgCl2��MgF2
D. ��ͼ��֪���¶���MgI2(s)��Cl2(g)��Ӧ���Ȼ�ѧ����ʽΪ��MgI2(s)��Cl2(g)=MgCl2(s)��I2(g)����H����277kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ѫ������Ӧ�ö�Ե�ʳ���ǣ�������
A.ˮ�����߲�
B.���������
C.������Ѽ��
D.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����(����)
A. ������������Һ����NO2 ��2OH�� + 2NO2��NO2��+ NO3��+ H2O
B. ʵ������Ũ������MnO2��Ӧ��Cl2��MnO2��2H����2Cl��![]() Mn2����Cl2����H2O
Mn2����Cl2����H2O
C. ��NaAlO2��Һ��ͨ�����CO2��2AlO2��+ CO2 + 3H2O��2Al(OH)3�� + CO32��
D. ��������Һ�еμ�����������Һ��ʹSO42-ǡ�ó�����ȫAl3++ 2SO42-+ 2Ba2++ 4OH-= 2BaSO4��+ AlO2-+ 2H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com