
【题目】已知A、B、C为中学化学中常见的单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们可以按如图进行反应。下列说法中正确的是

A. A、B、C中三种元素的任意两种元素形成的化合物所属物质类别可能是氧化物
B. A、B、C中三种元素的任意两种元素形成的化合物所属物质类别一定不是碱
C. 如果E溶液是一种强酸,则E溶液为硫酸
D. A、B、C中有一种金属且为B
【答案】B
【解析】由信息及上述转化关系可知,B为Cl2,E为HCl,C为氢气,D为金属和盐酸反应生成的氯化物盐,此盐可以直接由A和Cl2反应得到,说明则A一定不是变价金属铁,A可能是Na、Mg、Al等。A、若A为Na,B为氯气,C为氢气,三种元素中的任意两种元素形成的化合物一定不含O元素,不属于氧化物,选项A错误;B、若A为Na,B为氯气,C为氢气,三种元素中的任意两种元素形成的化合物一定不含O元素,不可能为碱,选项B正确;C、E为两种单质化合生成的物质,溶于水显酸性,不可能为硫酸,选项C错误;D、由上述分析可知,只有A为金属,B和C均为气体非金属单质,选项D错误。答案选B。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如下图所示,已知其燃烧热ΔH=-3677 kJ/mol(P被氧化为P4O10),下列有关P4S3的说法不正确的是()

A. 分子中每个原子最外层均达到8电子稳定结构
B. P4S3中硫元素为-2价,磷元素为+3价
C. 一个P4S3分子中含有三个非极性共价键
D. 热化学方程式为:P4S3(s)+8O2(g)=P4O10(s)+3SO2(g) ΔH=-3677 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列各装置图的叙述,不正确的是( )

A. 装置①可用于吸收实验中多余的Cl2
B. 装置②可用于收集H2、NH3、Cl2、HCl、NO等
C. 装置③中X为CCl4,可用于吸收氨气或氯化氢
D. 装置④可用于收集氨气,并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)已知: ![]() O2(g)═
O2(g)═ ![]() O2+(g)+
O2+(g)+ ![]() e﹣△H1=+587.9kJ/mol K1
e﹣△H1=+587.9kJ/mol K1
PtF6(g)+e﹣═PtF6﹣(g)△H2=﹣771.1kJ/mol K2
O2+PtF6﹣(s)═O2+(g)+PtF6﹣(g)△H3=+482.2kJ/mol K3
则反应O2(g)+PtF6(g)═O2+PtF6﹣(s)的△H= , K=(用K1、K2、K3表示)
(2)一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)FeO(s)+CO(g),已知该反应的平衡常数K 与温度T 的关系如图甲所示. 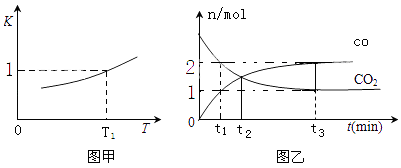
①T℃、p Pa压强下的密闭容器中进行反应,下列能说明反应达到平衡状态的是 .
a.混合气体的平均相对分子质量不再变化
b.容器内压强不再变化
c.v正(CO2)=v逆 (FeO)
d.CO2的体积分数不再变化
②T1温度下,向体积为VL的密闭容器中加入足量铁粉并充入一定量的CO2 , 达到平衡时则CO2的平衡转化率为;反应过程中体系的能量(增多或降低)
③T2温度下,恒容密闭容器中,反应过程中测定CO和CO2物质的量与时间的关系如图乙所示.则T1T2(填>、<或=),CO2的平衡转化率为 , 平衡时混合气体的密度与起始时气体的密度之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同、体积相同的下列溶液中,所含溶质的离子数目最多的是
A.NaCl溶液B.AlCl3溶液
C.Al2(SO4)3溶液D.Na2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学实验事实及其结论都正确的是
选项 | 实验事实 | 结论 |
A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体, | HNO3分解成了NO2 |
B | 向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
C | 取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体 | Na2O2没有变质 |
D | 取某溶液少量,加入盐酸酸化的氯化钡溶液,出现白色沉淀 | 该溶液中一定含有大量的SO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向x mL 2.0 mol·L-1的盐酸中投入a g镁铝合金,金属完全溶解,再加入y mL 1.0 mol·L-1的NaOH溶液沉淀达到最大值,且质量为(a+1.7) g,则下列说法不正确的是
A.x=2y
B.镁铝合金与盐酸反应时转移电子的数目为0.1NA
C.镁铝合金与盐酸反应产生H2的体积在常温常压下大于1.12 L
D.a的取值范围为0.9 g<a<1.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是
A. Na2O2中阴、阳离子的个数比为1∶1
B. Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等
C. Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等
D. Na2O2漂白后的有色物质受热后能恢复原色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镁晶体(MgSO4·7H2O)是一种重要的化工原料。以菱镁矿(主要成分是MgCO3,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体的流程如下:

(1)MgCO3溶于稀硫酸的离子方程式是_________________________。
(2)加入H2O2溶液的目的是____________________(用离子方程式表示)。
(3)已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Mg2+ | Fe2+ | Fe3+ |
开始沉淀 | 9.1 | 7.6 | 1.9 |
完全沉淀 | 11.1 | 9.7 | 3.2 |
“沉淀”步骤中,用氨水调节溶液pH的范围是______________________________。
(4)“过滤”所得滤液中存在大量的阳离子有Mg2+、____________。
(5)“结晶”步骤中需蒸发浓缩滤液,使用的仪器有铁架台、酒精灯和_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com