
【题目】联合国卫生组织认为我国使用的铁锅是有益于人类健康的理想炊具。其主要原因是( )
A. 价格便宜,不易生锈 B. 铁具有银白色光泽,导电性好
C. 烹调的食物中留有人体需要的铁元素 D. 传热慢,保温性能好
科目:高中化学 来源: 题型:
【题目】观察下列几个装置示意图,有关叙述正确的是( ) 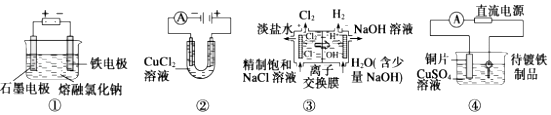
A.装置①工业上可用于生产金属钠,电解过程中石墨电极产生金属
B.装置②中阳极产生的气体可以使湿润的淀粉碘化钾试纸变蓝
C.装置③中的离子交换膜允许阳离子、阴离子和小分子水通过
D.装置④的待镀铁制品应与电源正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A: ①由C、H、O三种元素组成,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%
②如图是该有机物的质谱图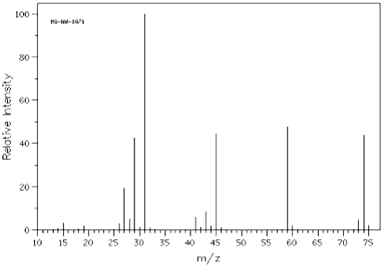
③A的红外光谱图上有C﹣H键、O﹣H键、C﹣O键的振动吸收峰.
④A的核磁共振氢谱有两个峰.请回答:
(1)A的实验式(最简式)为 , 相对分子质量为 , 分子式为 .
(2)已知A的最简式能否确定A的分子式(填“能”或“不能”) , 为什么 .
(3)A的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属腐蚀与防护的说法正确的是
A. 纯银器表面在空气中因电化学腐蚀渐渐变暗
B. 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C. 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
D. “辽宁号”外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镓有“电子工业脊梁”的美誉,镓及其化合物应用广泛。
(1) 镓(Ga)的原子结构示意图为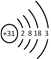 ,镓元素在周期表中的位置是_______。
,镓元素在周期表中的位置是_______。
(2)镓能与沸水剧烈反应生成氢气和氢氧化镓,该反应的化学方程式是______________。
(3)氮化镓在电和光的转化方面性能突出,是迄今理论上光电转化效率最高的材料。
资料:镓的熔点较低(29.8℃),沸点很高(2403℃)。
①传统的氮化镓(GaN)制备方法是采用GaCl3与NH3在一定条件下反应,该反应的化学方程式是____________________。
②当代工业上固态氮化镓(GaN)的制备方法是利用镓与NH3在1000℃高温下合成,同时生成氢气,每生成l mol H2时放出10.27 kJ热量。该可逆反应的热化学方程式是 ____________________________________。
③在密闭容器中,充入一定量的Ga与NH3发生上述反应,实验测得反应平衡体系中NH3的体积分数与压强P和温度T的关系曲线如图1所示。
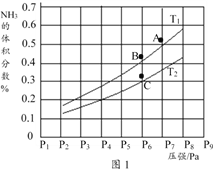
图中A点和C点化学平衡常数的关系是:KA_____ KC (填“>”“=”或“<”),理由是_____________________________。
(4)电解法可以提纯粗镓,具体原理如图2所示:
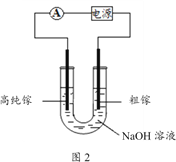
①粗镓与电源____极相连。(填“正”或“负”)
②镓在阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,GaO2-在阴极放电的电极反应式是
_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、H、N这三种化学元素在组成人体的化学成分中,质量分数共占73%左右,而这三种元素在岩石圈中质量分数还不到1%.这个事实说明了( )
A. 生物界与非生物界具有统一性
B. 生物界与非生物界具有差异性
C. 元素在自然界中都可以找到
D. 生物界具有特殊性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加入0.1 mol MnO2粉末于50 mL过氧化氢溶液(ρ=1.1 g·mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示。

(1)实验时放出气体的总体积是_______________________________________。
(2)放出一半气体所需的时间为_________________________________________。
(3)反应放出3/4气体所需时间为_________________________________________________。
(4)A、B、C、D各点反应速率快慢的顺序为________________________________________。
(5)解释反应速率变化的原因是_______________________________________________。
(6)计算H2O2的初始物质的量的浓度________________________________________。
(7)求反应到2 min时,H2O2的质量分数_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生在做元素性质与原子结构关系的实验时,设计了一套实验方案,并记录了有关的实验现象。请帮助该学生整理并完成实验报告。
(1)实验目的
探究同一主族元素性质的递变规律
(2)实验用品
仪器:试管、胶头滴管
药品:新制氯水、新制溴水、溴化钠溶液、碘化钠溶液、四氯化碳
(3)实验内容(在下表横线中填写相关内容)___________、__________
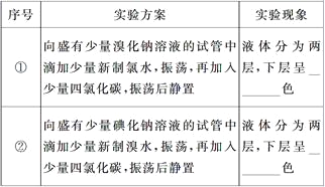
(4)实验结论:______________________________________________________________。
(5)问题和讨论
①上述两个实验中发生反应的离子方程式分别为____________________________、________________________________________________________________________。
②由于氟单质过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱。试列举两项事实说明氟的非金属性比氯的强________________、__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应:N2(g)+3H2(g) ![]() 2NH3(g)是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1mol H-H键、1mol N—H键、1mol N
2NH3(g)是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1mol H-H键、1mol N—H键、1mol N![]() N键放出的能量分别为436KJ、391KJ、946KJ。则:
N键放出的能量分别为436KJ、391KJ、946KJ。则:
(1)若1mol N2完全反应生成NH3可______(填“吸收”或“放出)热量_____KJ。
(2)如果将1mol N2 和 3mol H2混合,在一定条件下使其充分反应,反应放出的热量总小于上述数值,其原因是_____________________________________________________。
(3)实验室模拟工业合成氨时,在容积为2L的密闭容器中进行,反应经过10min后,生成10mol NH3,则用N2表示的化学反应速率是________mol·L -1·min-1。
(4)一定条件下,当成合成氨反应达到化学平衡时,下列说法正确的是(____)
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d. N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com