
����Ŀ��ijѧ������Ԫ��������ԭ�ӽṹ��ϵ��ʵ��ʱ�������һ��ʵ�鷽��������¼���йص�ʵ�������������ѧ�����������ʵ�鱨�档
(1)ʵ��Ŀ��
̽��ͬһ����Ԫ�����ʵĵݱ����
(2)ʵ����Ʒ
�������Թܡ���ͷ�ι�
ҩƷ��������ˮ��������ˮ���廯����Һ���⻯����Һ�����Ȼ�̼
(3)ʵ������(���±���������д�������)___________��__________
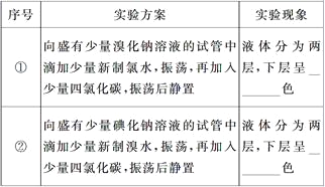
(4)ʵ����ۣ�______________________________________________________________��
(5)���������
����������ʵ���з�����Ӧ�����ӷ���ʽ�ֱ�Ϊ____________________________��________________________________________________________________________��
�����ڷ����ʹ��ڻ��ã����Ժ�����Ƴ�һ����ʵ������֤�������Ե�ǿ�������о�������ʵ˵�����ķǽ����Ա��ȵ�ǿ________________��__________________________��
���𰸡� �Ⱥ� �Ϻ� ͬ����Ԫ�ش��ϵ��£�Ԫ��ԭ�ӵĵõ����������� Cl2��2Br��===Br2��2Cl�� 2I����Br2===2Br����I2 ��������ȶ��Ա��Ȼ����ǿ �������û���ˮ�е����������������û���ˮ�е���
��������(3)��������������,�ܽ�����������Ϊ�嵥��,�嵥�����л�����ʾ�Ⱥ�ɫ���嵥���ܽ�����������Ϊ�ⵥ�����ⵥ�����л�������ʾ�Ϻ�ɫ��
(4)����ʵ����������������������ǿ��������������������ó�ͬ����Ԫ�����ʵĵݱ������
(5)����������������,�ܽ�����������Ϊ�嵥��,�嵥���ܽ�����������Ϊ�ⵥ����
�����ݵ��ʺ��������ϵõ����⻯����ȶ��ԡ�����֮����û���Ӧ���Եó�Ԫ�صķǽ�����ǿ��˳����
��3����������������,�ܽ�����������Ϊ�嵥��,�嵥�ʸ����������Ȼ�̼��,���л�����ʾ�Ⱥ�ɫ���嵥���ܽ�����������Ϊ�ⵥ��,�ⵥ�ʸ����������Ȼ�̼��,���л�������ʾ�Ϻ�ɫ����ȷ��:�Ⱥ����Ϻ���
(4)��������������,�ܽ�����������Ϊ�嵥��,����������������ǿ���嵥��,�嵥���ܽ�����������Ϊ�ⵥ��,�������������嵥��ǿ�ڵⵥ��,������Խǿ,Ԫ�صķǽ�����Խǿ,���ǽ�����:Cl>Br>I,�ó�ͬ����Ԫ�����ʵĵݱ����:ͬ����Ԫ����������,�Ҵ��ϵ���,Ԫ�صķǽ�������������ȷ����ͬһ����,���϶���,Ԫ�صķǽ��������μ�����
(5)����������������,�ܽ�����������Ϊ�嵥��, Cl2��2Br��===Br2��2Cl�����嵥���ܽ�����������Ϊ�ⵥ��2I����Br2===2Br����I2����ȷ��: Cl2��2Br��===Br2��2Cl����2I����Br2===2Br����I2��
��)�����������ֱ���������ϵõ����⻯����ȶ���:HF>HCl���⻯��Խ�ȶ����ǽ�����Խǿ������F�ķǽ����Ա�Clǿ��F2���û���ˮ�е���,��Cl2�����û���ˮ�е���,����F�ķǽ����Ա�Clǿ����ȷ������������ȶ��Ա��Ȼ����ǿ���������û���ˮ�е����������������û���ˮ�е�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊʵ��2Al+6H+![]() 2Al3++3H2��������ת��������װ���ܴﵽĿ����(�������ѳ�ȥ������Ĥ)
2Al3++3H2��������ת��������װ���ܴﵽĿ����(�������ѳ�ȥ������Ĥ)
A. 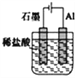 B.
B. 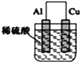
C.  D.
D. 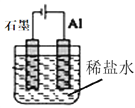
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ϲ�������֯��Ϊ�ҹ�ʹ�õ����������������ཡ�������봶�ߡ�����Ҫԭ������ ��
A. �۸���ˣ��������� B. ����������ɫ�������Ժ�
C. �����ʳ��������������Ҫ����Ԫ�� D. ���������������ܺ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У����������ȷ�Ӧ������������ԭ��Ӧ����
A.Al������ķ�ӦB.���ȵ�̼�������̼�ķ�Ӧ
C.̼������������ķ�ӦD.Ba(OH)2��8H2O��NH4Cl�ķ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ������ȼ�ϵ�ص�ʾ��ͼ����ͼ����ʾ��������������ȷ����(����)

A. a�缫�Ǹ�����b�缫������
B. a�缫�ĵ缫��ӦʽΪH2��2e��===2H��
C. b�缫�ĵ缫��ӦʽΪ4OH����4e��===2H2O��O2��
D. ����ȼ�ϵ�ز���Ҫ����ԭ����������ȫ�������ڵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���绯ѧ�ڻ�ѧ��ҵ���Ź㷺��Ӧ�ã�
��1����ҵұ�����Ļ�ѧ����ʽ����
��2����ҵ���������ص���Һ�к���ijЩ����������ʣ��������ӽ�����Ĥ������ᴿ��������װ�������ӽ���Ĥ��ֻ����������ͨ�������乤��ԭ����ͼ1��ʾ�� 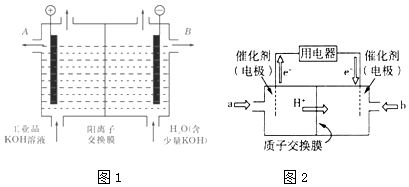
�ٸõ��۵�������Ӧʽ����
�ڳ�ȥ���ʺ������������Һ��Һ���������д��A����B����������
��3���״�ȼ�ϵ��������ṹ������ת���ʸߡ��Ի�������Ⱦ������Ϊ������Դ�����Ʒ��Խ��Խ�ܵ���ע���乤��ԭ����ͼ2�����ӽ���Ĥ�����������Һ��Ϊ1L 1.5mol/L H2SO4��Һ�� ��ͨ������a�ĵ缫�ǵ�ص��������������������缫��ӦʽΪ��
�ڵ��������2mol e������ת��ʱ������������Һ��������ֵΪg��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() U����Ҫ�ĺ˹�ҵԭ�ϣ������й�
U����Ҫ�ĺ˹�ҵԭ�ϣ������й� ![]() U��˵����ȷ���ǣ�������
U��˵����ȷ���ǣ�������
A.![]() U��
U�� ![]() U��Ϊͬ��������
U��Ϊͬ��������
B.![]() U��
U�� ![]() U��Ϊͬλ��
U��Ϊͬλ��
C.![]() Uԭ�Ӻ��к���92������
Uԭ�Ӻ��к���92������
D.![]() Uԭ�Ӻ�����143������
Uԭ�Ӻ�����143������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ǽס��ҡ�����λͬѧ��ȡ���������Ĺ��̣�������벢Э������������ʵ������
��ʵ��Ŀ�ġ���ȡ��������
��ʵ��ԭ�����ס��ҡ�����λͬѧ����ȡ�Ҵ���������Ũ�����Ϲ��ȵķ�����ȡ����������
��װ����ơ��ס��ҡ�����λͬѧ�ֱ��������������ʵ��װ�ã�
��Ӽס�����λͬѧ��Ƶ�װ����ѡ��һ����Ϊʵ������ȡ����������װ�ã��Ϻ�������________(ѡ��ס����ҡ�)����ͬѧ����װ�ý����˸Ľ��������еIJ����ܸij������θ���ܣ��������������⣬��һ��Ҫ������_______��
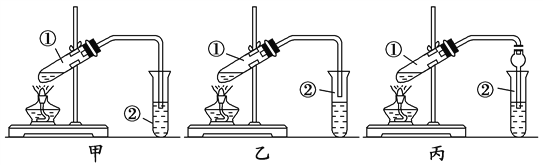
��ʵ�鲽�衿
��1���þƾ��ƶ��Թܢټ��ȣ���2�����Թܢٹ̶�������̨�ϣ�3������ѡ���װ����װ���������Թܢ����ȼ���3 mL�Ҵ�������ҡ���»�������2 mLŨ������ҡ�ȣ���ȴ���ټ���2 mL�������4�����Թܢ��м��������ı���Na2CO3��Һ����5�����۲쵽�Թܢ�������������ʱֹͣʵ�顣
���������ۡ�
a�������д����ʵ��IJ���____________��
b��װ��ʵ��װ�ã�����ҩƷǰ��Ӧ���____________��
c��д���Թܢٷ�����Ӧ�Ļ�ѧ����ʽ(ע����Ӧ����) _____________________��
d���Թܢ��б���Na2CO3��Һ��������_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ˮ��������Ե����� ��
A. Ũ���� B. ���� C. �Ȼ�� D. ��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com