
【题目】如图,将一根纯铁棒垂直没入水中,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重.下列关于此现象的说法不正确的是
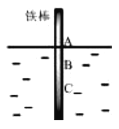
A.铁棒AB段的溶解氧浓度高于BC段
B.铁棒AB段电极反应为O2+2H2O+4e-=4OH-
C.铁棒AB段的Fe2+浓度高于BC段
D.该腐蚀过程属于电化学腐蚀
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】物质A~K存在下图转化关系,其中气体D为单质,E为氯气。试回答下列问题:
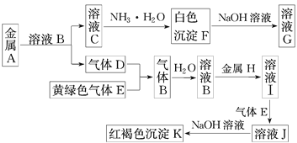
(1)写出下列物质的化学式:A是________。
(2)写出下列反应的离子方程式:
C→F____________________________________________
I→J_____________________________________________
(3)在溶液I中滴入NaOH溶液,可观察到的现象是___________________________,其反应的原理为____________________________________(写化学方程式)。
(4)检验溶液J中的金属阳离子,所选用的试剂为__________(填化学式),现象为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用芳香族化合物A制取有机物F的合成路线如下:
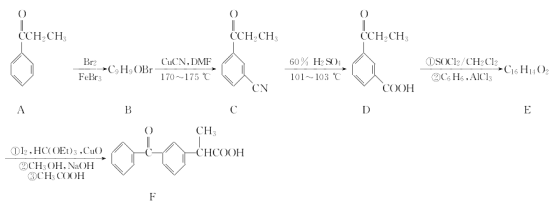
已知:![]()
回答下列问题:
(1)A的分子式为_____________;B→C的反应类型为____________。
(2)足量的D与Na2CO3溶液发生反应的化学方程式:_______________________________。
(3)E的结构简式为______________。
(4)碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳。写出上述合成路线中含有手性碳的物质结构简式并用星号(*)标出手性碳:______________。
(5)芳香族化合物M与A互为同分异构体,且M能发生银镜反应,则M的结构有________种(不考虑立体异构);其中核磁共振氢谱显示有4种不同化学环境的氢且峰面积之比为6:2:1:1的结构简式有____________________________________________________(任写一种)。
(6)结合已知信息写出用1-溴丙烷和苯为原料制备![]() 的合成路线(其他试剂任选)。
的合成路线(其他试剂任选)。
_________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯是重要的有机中间体,实验室制取少量硝基苯的装置如图所示。
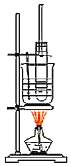
(1)写出制取硝基苯的化学方程式_____。
(2)该实验先在大试管中配制混合酸,配制混合酸的注意事项是_____并及时冷却。及时冷却的可能原因是_____。
(3)长玻璃导管兼做冷凝管,冷凝的是_____(填“物质名称”)。
(4)将除去混酸后的粗硝基苯先用冷水洗涤,再用10%碳酸钠溶液洗至不显酸性,最后用水洗至中性。洗涤和分离粗硝基苯的仪器是_____(填仪器名称)。检验最后用水洗至中性的操作是_____。
(5)经上述洗涤的硝基苯中仍含少量的苯等杂质,提纯硝基苯的方法是_____。硝基苯有毒,如果少量的液体溅在皮肤上,应用_____擦洗。
A.苯 B.酒精 C.硫酸 D.水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“NaH2PO2还原法”制备高纯度氢碘酸和亚磷酸钠(Na2HPO3)的工业流程如图。
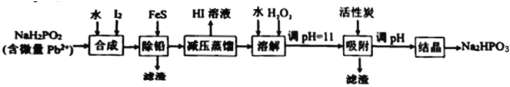
已知:25℃时,H3PO3的pKa1=1.3,pKa2=6.6。
(1)“合成”过程,主要氧化产物为H3PO3,相应的化学方程式为___________。
(2)“除铅”过程,FeS除去微量Pb2+的离子方程式为___________。
(3)“减压蒸馏”过程,I-回收率为95%,则剩余固体的主要成分为___________(填化学式)。
(4)“调pH=11”的作用是___________。
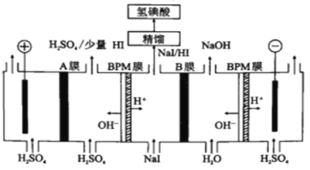
(5)氢碘酸也可以用“电解法”制备,装置如图所示。其中双极膜(BPM)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-;A、B为离子交换膜。
①B膜最佳应选择___________
②阳极的电极反应式是___________。
③少量的I-因为浓度差通过BPM膜,若撤去A膜,其缺点是:___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示物质结构的化学用语或模型正确的是( )
A.C原子外围电子排布图:![]() B.硫原子结构示意图:
B.硫原子结构示意图:![]()
C.二氧化硅的分子式:SiO2D.Na原子的电子排布式:1s22s22p63s1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.饱和Na2CO3溶液与CaSO4固体反应:CO![]() +CaSO4=CaCO3+SO
+CaSO4=CaCO3+SO![]()
B.酸化NaIO3和NaI的溶液混合:I-+IO![]() +6H+=I2+3H2O
+6H+=I2+3H2O
C.KClO碱性溶液与Fe(OH)3反应:3ClO-+2Fe(OH)3=2FeO![]() +3Cl-+4H++H2O
+3Cl-+4H++H2O
D.电解饱和食盐水:2Cl-+2H+![]() Cl2↑+H2↑
Cl2↑+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业处理含铬废水,操作及现象如图1,反应过程中铬元素的化合价变化如图2。下列说法正确的是( )
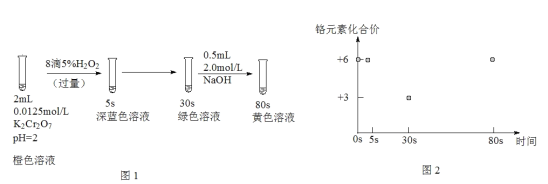
已知:深蓝色溶液中生成了CrO5。
A.实验开始至5s,铬元素被氧化
B.实验开始至30s,溶液中生成Cr3+的总反应离子方程式为:Cr2O![]() +3H2O2+8H+=2Cr3++7H2O+3O2↑
+3H2O2+8H+=2Cr3++7H2O+3O2↑
C.30s至80s的过程,一定是氧气氧化了Cr3+
D.80s时,溶液中又生成了Cr2O![]() ,颜色相比于开始时浅,是水稀释所致
,颜色相比于开始时浅,是水稀释所致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂/氟化碳电池稳定性很高。电解质为LiClO4的二甲醚溶液,总反应为xLi+CFx=xLiF+C,放电产物LiF沉积在正极,工作原理如图所示。下列说法正确的是( )

A.交换膜为阴离子交换膜
B.正极的电极反应式为CFx+xe-+xLi+=xLiF+C
C.电解质溶液可用LiClO4的乙醇溶液代替
D.a极电势高于b极电势
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com