
【题目】“NaH2PO2还原法”制备高纯度氢碘酸和亚磷酸钠(Na2HPO3)的工业流程如图。
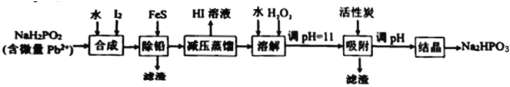
已知:25℃时,H3PO3的pKa1=1.3,pKa2=6.6。
(1)“合成”过程,主要氧化产物为H3PO3,相应的化学方程式为___________。
(2)“除铅”过程,FeS除去微量Pb2+的离子方程式为___________。
(3)“减压蒸馏”过程,I-回收率为95%,则剩余固体的主要成分为___________(填化学式)。
(4)“调pH=11”的作用是___________。
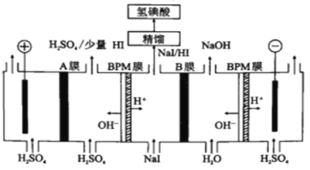
(5)氢碘酸也可以用“电解法”制备,装置如图所示。其中双极膜(BPM)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-;A、B为离子交换膜。
①B膜最佳应选择___________
②阳极的电极反应式是___________。
③少量的I-因为浓度差通过BPM膜,若撤去A膜,其缺点是:___________
【答案】NaH2PO2+I2+H2O=H3PO3+NaI+HI FeS(s)+Pb2+(aq)=PbS(s)+Fe2+(aq) NaH2PO3 除去铁,并将NaH2PO3转变为Na2HPO3 Na+离子交换膜 2H2O-4e-=O2↑+4H+ I-会在阳极放电,沉积在阳极表面,损伤阳极板
【解析】
“合成”步骤,NaH2PO2和I2和水反应生成H3PO3和NaI和HI;之后加入FeS将Pb2+转化为PbS除去,此时溶液中的杂质为Fe2+;因为HI易挥发,“减压蒸馏”获得HI溶液,剩余固体主要为含有Fe2+杂质的NaH2PO3,加水溶解,再加入H2O2将Fe2+氧化成Fe3+,调pH=11将Fe3+转化为沉淀除去,同时部分NaH2PO3转换为了Na2HPO3;再次调pH将NaH2PO3彻底转化为Na2HPO3,最后“结晶”得到Na2HPO3固体,据此分析解答。
(1)根据后续流程可知“合成”步骤中产生HI,说明I2将NaH2PO2氧化,HI为强酸,所以还生成H3PO3和NaI,根据电子守恒和元素守恒可得该反应的化学方程式为:NaH2PO2+I2+H2O= H3PO3+NaI+HI;
(2)“除铅”过程,利用沉淀转化原理,加入FeS将Pb2+变成PbS,离子方程式为:FeS(s)+Pb2+(aq)=Fe2+(aq)+PbS(s);
(3)根据合成步骤的反应,可知蒸馏前溶液中主要含H3PO3、NaI和HI,而蒸馏过程I-回收率为95%,说明H3PO3和NaI反应有NaH2PO3生成,则剩余固体的主要成分为NaH2PO3;
(4)“调pH=11”的作用:将Fe3+转化为沉淀除去,同时将NaH2PO3转换为了Na2HPO3;
(5)①从图上看,右端的BPM膜和B膜之间产生NaOH,BPM膜提供OH-,所以B膜最好是钠离子交换膜;
②阳极附近溶液为硫酸溶液,水电离的氢氧根失电子产生氧气,同时产生氢离子,故阳极的电极反应式为:2H2O-4e-=O2↑+4H+;
③电解池中阴离子有向阳极移动的趋势,少量的I-因为浓度差通过BPM膜,若没有A膜的阻挡,I-会在阳极失电子得到碘单质,沉积在阳极表面,损伤阳极板。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.25℃时某溶液中水电离出的c(H+)=1.0×1012 mol·L1,其pH一定是12
B.某温度下,向氨水中通入CO2,随着CO2的通入,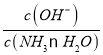 不断增大
不断增大
C.恒温恒容下,反应X(g)+3Y(g) ![]() 2Z(g),起始充入3 mol X和3 mol Y,当X的体积分数不变时,反应达到平衡
2Z(g),起始充入3 mol X和3 mol Y,当X的体积分数不变时,反应达到平衡
D.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,该温度下加入等体积pH=10的NaOH溶液可使反应后的溶液恰好呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A. pH=l 的溶液中:Ba2+、Fe3+ 、Cl-、SCN-
B. 能使酚酞变红的溶液:Ca2+、K+、HCO3-、CO32-
C.  =10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
D. 由水电离的c(H+)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:

(1)写出得到单质铁的化学方程式:_________________________。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁:______。
(3)装置末端气球的作用为_____________________________。实验结束时,应该先停止加热还是先停止通入CO?原因是什么?_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度以上
② 固定好滴定管并使滴定管尖嘴充满液体
④调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。
填空:(1)以上步骤有错误的是(填编号)_________,该错误操作会导致测定结果__________。(填“偏大”、“偏小”或“无影响”)
(2)步骤⑤中,在记录滴定管液面读数时,滴定管尖嘴有气泡,导致测定结果____________。(填“偏大”、“偏小”或“无影响”)
(3)判断滴定终点的现象是:___________________________________;
(4)如下图是某次滴定时的滴定管中的液面,其读数为_________mL

(5)根据下列数据:请计算待测盐酸溶液的浓度:_______________________mol·L-1
滴定次数 | 待测液体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,将一根纯铁棒垂直没入水中,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重.下列关于此现象的说法不正确的是
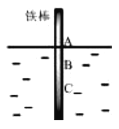
A.铁棒AB段的溶解氧浓度高于BC段
B.铁棒AB段电极反应为O2+2H2O+4e-=4OH-
C.铁棒AB段的Fe2+浓度高于BC段
D.该腐蚀过程属于电化学腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.澄清石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
B.硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH﹣=BaSO4↓+2H2O
C.向氢氧化钠溶液中通入足量CO2:2OH-+CO2=CO32-+H2O
D.向明矾[KAl(SO4)2·12H2O]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为
A.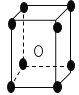 B.
B.
C.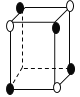 D.
D.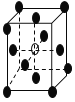
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒温恒容密闭容器中存在反应:X(g)+2Y(g)![]() Z(g) ΔH=-akJmol-1(a>0),现向该容器中充入等物质的量的X(g)与Y(g)充分反应。下列说法正确的是
Z(g) ΔH=-akJmol-1(a>0),现向该容器中充入等物质的量的X(g)与Y(g)充分反应。下列说法正确的是
A.体系中混合气体的总压强保持不变时,说明该反应达到化学平衡状态
B.达到平衡时,反应放出的热量一定小于akJ
C.达到平衡时,X与Y的物质的量之比仍为1∶1
D.达到平衡后,若升高体系温度,则逆反应速率增大、正反应速率减小,平衡逆移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com