
【题目】某恒温恒容密闭容器中存在反应:X(g)+2Y(g)![]() Z(g) ΔH=-akJmol-1(a>0),现向该容器中充入等物质的量的X(g)与Y(g)充分反应。下列说法正确的是
Z(g) ΔH=-akJmol-1(a>0),现向该容器中充入等物质的量的X(g)与Y(g)充分反应。下列说法正确的是
A.体系中混合气体的总压强保持不变时,说明该反应达到化学平衡状态
B.达到平衡时,反应放出的热量一定小于akJ
C.达到平衡时,X与Y的物质的量之比仍为1∶1
D.达到平衡后,若升高体系温度,则逆反应速率增大、正反应速率减小,平衡逆移
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】“NaH2PO2还原法”制备高纯度氢碘酸和亚磷酸钠(Na2HPO3)的工业流程如图。
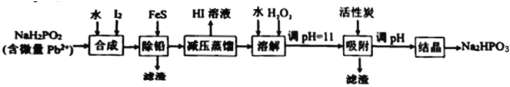
已知:25℃时,H3PO3的pKa1=1.3,pKa2=6.6。
(1)“合成”过程,主要氧化产物为H3PO3,相应的化学方程式为___________。
(2)“除铅”过程,FeS除去微量Pb2+的离子方程式为___________。
(3)“减压蒸馏”过程,I-回收率为95%,则剩余固体的主要成分为___________(填化学式)。
(4)“调pH=11”的作用是___________。
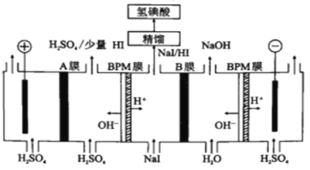
(5)氢碘酸也可以用“电解法”制备,装置如图所示。其中双极膜(BPM)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-;A、B为离子交换膜。
①B膜最佳应选择___________
②阳极的电极反应式是___________。
③少量的I-因为浓度差通过BPM膜,若撤去A膜,其缺点是:___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中提取碘的流程如图,已知氧化过程发生反应的化学方程式为:Cl2+2KI=2KCl+I2。请回答下列问题:
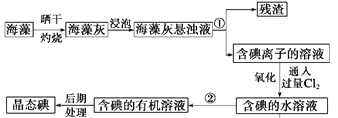

(1)指出提取碘的过程中有关实验操作①和②的名称:___;___。
(2)在3 mL含碘的水溶液中加入1mL四氯化碳,振荡静置后观察到试管里的分层现象是图中的___(注:试管中深色区为有色溶液),上层无色溶液的溶质是___,下层颜色是___。
(3)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过的操作是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B. ![]() =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C. 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D. 水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水存在如下电离:H2O![]() H++OH- H>0,下列叙述正确的是
H++OH- H>0,下列叙述正确的是
A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小
B.将水加热,Kw增大,pH减小
C.向水中加入少量固体NH4Cl,平衡逆向移动,c(H+)降低
D.向水中加入少量固体硫酸钠,c(H+)=10-7mol/L,Kw不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂/氟化碳电池稳定性很高。电解质为LiClO4的二甲醚溶液,总反应为xLi+CFx=xLiF+C,放电产物LiF沉积在正极,工作原理如图所示。下列说法正确的是( )

A.交换膜为阴离子交换膜
B.正极的电极反应式为CFx+xe-+xLi+=xLiF+C
C.电解质溶液可用LiClO4的乙醇溶液代替
D.a极电势高于b极电势
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水四氯化锡(SnC14)是一种用途广泛的化工中间体,常用作媒染剂和有机合成的氯化催化剂。熔融的金属锡(熔点231℃)在300℃左右能直接与Cl2作用生成无水四氯化锡,实验室装置如图所示:

已知信息如下:①将金属锡熔融,通人干燥氯气进行反应,生成四氯化锡。②无水四氯化锡是无色易流动的液体,熔点为一33℃,沸点为114.1℃。二氯化锡是无色晶体,熔点为246℃,沸点为652℃。③无水四氯化锡在空气中极易水解,水解产物之一是SnO2.xH2O,并产生白烟。请回答下列问题:
(l)开始实验前一定要____,E中冷水的作用是 ___。
(2)装置F中盛放的最佳试剂为 ___,作用是____。
(3)实验时应先打开A处分液漏斗旋塞和整套装置的阀门,待观察到____这一现象时,再点燃D处酒精灯。
(4)若撤去装置C,则D中还可能发生反应的化学方程式为 __。
(5) Cl2和锡作用即可生成SnC14,也会生成SnCl2,为减少SnCl2的生成,可采取的措施是 _______ .
(6)得到的产物中常含有杂质SnCl2,SnCl2是常用的还原剂。某实验小组用碘氧化法滴定分析产品中杂质SnCl2的质量分数。准确称取a克该样品于锥形瓶,用适量浓盐酸溶解,淀粉溶液作指示剂,c mol.L-l碘标准溶液滴定至终点,消耗标准液20. 00mL,已知滴定原理是:SnCl2+2HCl+I2=SnC14+2HI,则产品中杂质SnCl2的质量分数为____(用含a、c的代数式表示);即使此法测定的操作均正确,但测得的SnCl2含量仍低于实际含量,其原因可能是________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率可用于衡量电解质溶液导电能力的大小。室温下,用0.100 mol·L-1 NH3·H2O滴定10 mL浓度均为0.100 mol·L-1HCl和CH3COOH的混合液,电导率曲线如图所示。
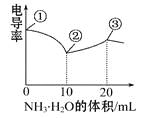
下列说法正确的是
A.①溶液中c(H+)为0.200 mol·L-1
B.溶液温度高低为①>③>②
C.③点溶液中有c(Cl-)>c(CH3COO-)
D.③点后因离子数目减少使电导率略降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com