
【题目】海藻中提取碘的流程如图,已知氧化过程发生反应的化学方程式为:Cl2+2KI=2KCl+I2。请回答下列问题:
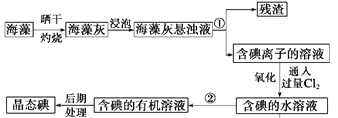

(1)指出提取碘的过程中有关实验操作①和②的名称:___;___。
(2)在3 mL含碘的水溶液中加入1mL四氯化碳,振荡静置后观察到试管里的分层现象是图中的___(注:试管中深色区为有色溶液),上层无色溶液的溶质是___,下层颜色是___。
(3)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过的操作是___。
【答案】过滤 萃取分液 D KCl 紫红色 蒸馏
【解析】
由流程可知,晒干后在坩埚中灼烧,浸泡后过滤分离出含碘离子的溶液,通入氯气发生Cl2+2KI═2KCl+I2,得到含碘水溶液,再加有机溶剂萃取分液分离出碘的有机溶液,蒸馏分离出碘。
(1)提取碘的过程中有关实验操作①和②的名称分别为过滤、萃取分液,
故答案为:过滤;萃取分液;
(2)四氯化碳的密度比水的密度大,分层后有机层在下层,振荡静置后观察到试管里的分层现象是上图中的D,上层无色溶液的溶质是KCl,下层颜色是紫红色,
故答案为:D;KCl; 紫红色;
(3)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过的操作是蒸馏;
故答案为:蒸馏。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A. pH=l 的溶液中:Ba2+、Fe3+ 、Cl-、SCN-
B. 能使酚酞变红的溶液:Ca2+、K+、HCO3-、CO32-
C.  =10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
D. 由水电离的c(H+)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.澄清石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
B.硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH﹣=BaSO4↓+2H2O
C.向氢氧化钠溶液中通入足量CO2:2OH-+CO2=CO32-+H2O
D.向明矾[KAl(SO4)2·12H2O]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为
A.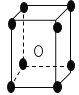 B.
B.
C.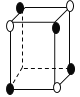 D.
D.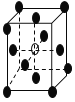
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质:①氢氧化钡固体 ②KHSO4 ③HNO3 ④稀硫酸 ⑤二氧化碳气体 ⑥铁 ⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠 ⑩CuSO4·5H2O晶体。请用序号填空:
(1)上述状态下可导电的是___。
(2)属于电解质的是___。
(3)属于非电解质的是____。
(4)⑥和水蒸气反应的化学方程式为___,①与②在溶液中反应使溶液呈中性的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在电压为24V时进行如下实验,电解3分钟后,发现下列现象。
编号 | ① | ② | ③ |
装置 |
|
|
|
现象 | 小灯泡微弱发光,两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 | 两极均产生气泡,溶液无明显变化 | 两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 |
下列说法正确的是( )
A.①中小灯泡微亮是因为Ca(OH)2是弱电解质
B.对比①和②,白色浑浊的出现与电极材料无关
C.对比①和③,白色浑浊是由于OH-迁移到阳极使Ca(OH)2沉淀析出
D.阳极附近白色沉淀的成分可能是CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I-测定的基本原理是将其氧化成I2,再用Na2S2O3标准溶液来滴定。如果样品中仅含有微量I-,必须用“化学放大”反应将碘的量“放大”,然后再进行测定。下面是化学放大反应的实验步骤:
I.将含有微量I-的样品溶液调至中性或弱酸性,加入溴水,将I-完全氧化成IO![]() ,煮沸去掉过量的溴;
,煮沸去掉过量的溴;
Ⅱ.取上述溶液,加入过量硫酸酸化的KI溶液,振荡,溶液颜色呈棕黄色;
Ⅲ.将Ⅱ所得溶液中全部的I2萃取至CCl4中;
Ⅳ.向分液后的CCl4溶液中加入肼(N2H4)的水溶液,产生无毒的N2,分去有机层;
V.将Ⅳ所得水溶液重复I、Ⅱ步骤;
Ⅵ.以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点。已知:反应为:I2+2S2O![]() =2I-+S4O
=2I-+S4O![]() ;Na2S2O3和Na2S4O6溶液颜色均为无色。
;Na2S2O3和Na2S4O6溶液颜色均为无色。
(1)I中氧化剂和还原剂物质的量之比为______。
(2)Ⅲ中使用的主要玻璃仪器是______(填名称)。
(3)Ⅳ中反应的离子方程式是______。
(4)Ⅵ中需要在中性或弱酸性环境中进行,pH过大,Na2S2O3易被I2氧化成Na2SO4,其离子方程式为_______;结合离子方程式解释pH不宜过小的原因:______。VI中滴定终点的现象是______。
(5)样品中I-最终所消耗的Na2S2O3的物质的量与样品中初始I-物质的量的比值称为“放大倍数”。经过以上操作,放大倍数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒温恒容密闭容器中存在反应:X(g)+2Y(g)![]() Z(g) ΔH=-akJmol-1(a>0),现向该容器中充入等物质的量的X(g)与Y(g)充分反应。下列说法正确的是
Z(g) ΔH=-akJmol-1(a>0),现向该容器中充入等物质的量的X(g)与Y(g)充分反应。下列说法正确的是
A.体系中混合气体的总压强保持不变时,说明该反应达到化学平衡状态
B.达到平衡时,反应放出的热量一定小于akJ
C.达到平衡时,X与Y的物质的量之比仍为1∶1
D.达到平衡后,若升高体系温度,则逆反应速率增大、正反应速率减小,平衡逆移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含CH3COOH和CH3COO-的溶液中, CH3COOH、CH3COO-二者中各自所占的物质的量分数(a)随溶液pH变化的关系如图所示。

下列说法不正确的是
A. 在pH<4.76的溶液中,c(CH3COO-)<c(CH3COOH)
B. 在pH=7的溶液中,a(CH3COOH)=0,a(CH3COO-)=1.0
C. 在pH>4.76的溶液中,c(CH3COO-)与c(OH-)之和可大于c(H+)
D. 在pH=4.76的溶液中加盐酸,a(CH3COOH)与a(CH3COO-)之和保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com