
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A. pH=l 的溶液中:Ba2+、Fe3+ 、Cl-、SCN-
B. 能使酚酞变红的溶液:Ca2+、K+、HCO3-、CO32-
C.  =10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
D. 由水电离的c(H+)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、NO3-
【答案】C
【解析】A. pH=l 的溶液显酸性,Fe3+ 与SCN-那个反应生成络合物,故A错误;B. 能使酚酞变红的溶液显碱性,碱性溶液中HCO3-不能大量存在,且Ca2+与CO32-那个反应生成碳酸钙沉淀,故B错误;C.  =10-12的溶液显酸性,在酸性溶液中NH4+、Cu2+、NO3-、SO42-离子间不能发生反应,能够大量共存,故C正确;D. 由水电离的c(H+)=10-12mol·L-1的溶液显酸性或碱性,在碱性溶液中Al3+反应生成氢氧化铝沉淀,不能大量存在,故D错误;故选C。
=10-12的溶液显酸性,在酸性溶液中NH4+、Cu2+、NO3-、SO42-离子间不能发生反应,能够大量共存,故C正确;D. 由水电离的c(H+)=10-12mol·L-1的溶液显酸性或碱性,在碱性溶液中Al3+反应生成氢氧化铝沉淀,不能大量存在,故D错误;故选C。
点晴:本题考查离子共存的正误判断。解决离子共存问题时要注意题目所隐含的条件,如:溶液的酸碱性、溶液的颜色等。本题的易错点是A,要注意Fe3+和 SCN-能发生络合反应。


科目:高中化学 来源: 题型:
【题目】某酸件废水可能含有Fe2+、Fe3+、Al3+、Mg2+、Na+、K+、CO32-、SO42-。取废水祥品分别进行如图所示①~④四个实验。下列推断正确的是

A. 废水含有Na+,不含K+
B. 废水含有SO42-和CO32-
C. 废水不含Fe3+,可能含Fe2+
D. 废水一定含有Na+、Al3+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)已知NaHA水溶液呈碱性。
①用离子方程式及文字表示NaHA水溶液呈碱性的原因__________________。
②在NaHA水溶液中各离子浓度的大小关系是______________。
(2)25℃时,向浓度均为0.1mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为__________________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
Ⅱ.(5分)已知二元酸H2A在水中存在以下电离:H2A=H++HA-,HA -![]() H++A2-。试回答下列问题:(1)NaHA溶液呈________(填“酸”、“碱”或“中”)性,理由是___________________。
H++A2-。试回答下列问题:(1)NaHA溶液呈________(填“酸”、“碱”或“中”)性,理由是___________________。
(2)某温度下,向10mL、0.1mol/L NaHA溶液中加入0.1mol/L KOH溶液VmL至中性,此时溶液中以下关系一定正确的是_________(填写字母)。
A.溶液pH=7 B.水的离子积Kw=[c2(OH-)]
C.V=10 D.c(K+)<c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸是一种酸性极强的无机含氧酸,可用于制备高氯酸盐、人造金刚石提纯等方面。查阅资料得到以下有关高氯酸的信息:
名称 | 分子式 | 外观 | 沸点 |
高氯酸 | HClO4 | 无色液体 | 130℃ |
工业上生产高氯酸的同时还生产了亚氯酸钠,工业流程如下:

(1)操作①的名称是____________,操作②的名称是___________。
(2)反应器Ⅰ中发生反应的化学方程式为________________________。
(3)反应器Ⅱ中发生反应的离子方程式为__________________________。
(4)若反应器Ⅱ中SO2以H2O2代替也可达到同样的目,此时发生反应的离子方程式为___________。
(5)若想得到201kg的HClO4纯品,至少需要NaClO3_________kg。
(6)工业上也可用铂作阳极、铜作阴极电解盐酸制得高氯酸,在阳极区可得到20%的高氯酸。写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现)______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.一定温度下,某容积为2 L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如右图,依图所示:
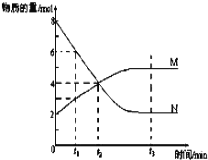
(1)该反应的化学方程式是____________________________。
(2)在图上所示的三个时刻中,_______(填t1、t2或t3)时刻达到化学反应限度。
II.一定温度下将6 mol A及6 mol B混合于2 L的密闭容器中,
发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36 mol/(L·min)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36 mol/(L·min)。求:
(1)平衡时D的浓度=___________________。
(2)B的平均反应速率υ(B)= ___________________________。
(3)x=_________。
(4)开始时容器中的压强与平衡时的压强之比为______________(化为最简整数比)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应N2(g)+3H2(g) ![]() 2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
A . N2,H2的和NH3的质量分数不再改变
B.c(N2):c(H2):c(NH3)=1:3:2
C .N2和H2的物质的量之和NH3的物质的量的2倍
D. 单位时间内每增加1molN2,同时增加3molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铁是合成草酸铁的重要原料。
(1)利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3·5H2O]的实验流程如下图所示:
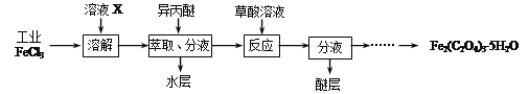
①为抑制FeCl3水解,溶液X为 。
②上述流程中FeCl3能被异丙醚萃取,其原因是 ;检验萃取、分液后所得水层中是否含有Fe3+的方法是 。
③所得Fe2(C2O4)3·5H2O需用冰水洗涤,其目的是 。
④为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于如图所示仪器 (填“甲”或“乙”)中。下列情况会造成实验测得Fe2(C2O4)3·5H2O含量偏低的是 。

a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
(2)某研究性学习小组欲从蚀刻镀铜电路板所得废液(溶质为FeCl2、CuCl2、FeCl3)出发,制备单质铜和无水FeCl3,再由FeCl3合成Fe2(C2O4)3·5H2O。请补充完整由蚀刻废液制备单质铜和无水FeCl3的实验步骤(可选用的试剂:铁粉、盐酸、NaOH溶液和H2O2溶液):向废液中加入足量铁粉,充分反应后过滤;__________;___________;调节溶液pH,将溶液蒸发浓缩、冷却结晶、过滤、洗涤干燥得FeCl3·6H2O; ___________,得到无水FeCl3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com