
【题目】铜,锌元素的化合物种类很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)CuSO4和Cu(NO3)2是自然界中重要的铜盐。
① CuSO4和Cu(NO3)2中阳离子的基态价层电子排布式为_______________。
② S、O、N三种元素的第一电离能由大到小为_____________。
③ CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因是________。
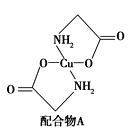
(2)硫酸铜溶液中滴入氨基乙酸钠(H2NCH2COONa)即可得到配合物A,其结构如图所示。请回答下列问题:
① 配合物A中N原子的轨道杂化类型为__________。
② 1 mol配合物A含有σ键的数目为_____________。
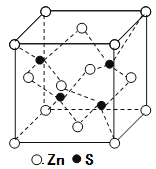
(3)立方ZnS晶体的密度为ρg·cm-3, 其晶胞结构如图。S2-周围等距离且最近的Zn2+、S2-依次为______、______;ZnS晶胞中的晶胞参数a=________nm(列出计算式)。
【答案】 3d9 N>O>S CuSO4和Cu(NO3)2均为离子晶体,SO42-所带电荷比NO3-大,故CuSO4晶格能较大,熔点较高 sp3 20mol 4 12 ![]()
【解析】(1)① CuSO4和Cu(NO3)2中阳离子为Cu2+,Cu为29号元素,其基态电子排布式为1s22s22p63s23p63d104s1,转变成Cu2+时,首先失去最外层能量最高的4s电子,然后失去能量稍低的3d电子,所以Cu2+基态电子排布式为1s22s22p63s23p63d9,基态外围电子排布式为3d9。② S和O位于同一主族,S在O的下方,所以O的第一电离能更大;N和O位于同一周期,N位于O的左侧,但是由于N的电子排布为1s22s22p3,2p为半充满状态,所以N的第一电离能更大,即第一电离能:N>O>S。③ CuSO4和Cu(NO3)2均为离子晶体,熔点的大小取决于晶体的晶格能,组成中,由于SO42-带有2个单位负电荷,而NO3-只有一个单位负电荷,所以CuSO4晶体晶格能更大,熔点更高。(2)①配合物A中N原子连接1个H原子和2个C原子,无孤对电子,因此其杂化方式为sp3。②两个五元环各5个σ键,2个N原子连接的另外4个H原子共有4个σ键,环上下2个C原子各连接2个H原子共4个σ键,环连接的O原子含有1个σ键,所以σ键总数为5+5+4+4+2=20。(3)ZnS晶胞结构中S2-周围等距离且最近的Zn2+为4,S2-周围等距离且最近的S2-依次为12;ZnS晶胞中的晶胞参数a为xnm,则晶胞的体积为(x×10-6cm)3,晶胞中含有4个ZnS,则1mol晶胞的质量为97×4g,1mol晶胞的体积为(x×10-7cm)3×6.02×1023,则ZnS晶体的密度为ρg·cm-3=(97×4g)÷[(x×10-7cm)3×6.02×1023],解得x=![]() nm。
nm。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某一重要烃的衍生物,其结构简式如图所示,下列说法中正确的是
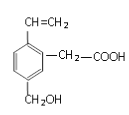
A. 该物质的分子式为C11H13O3
B. 该物质可以使酸性高锰酸钾溶液褪色,证明其含有碳碳双键
C. 1mol该有机物,一定条件下最多可以和5molH2加成
D. 1mol该有机物,与Na和NaHCO3反应产生的气体在相同条件下体积比为1 :1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na2SO4、NaCl、NaOH的混合溶液中,含有Na+、SO42-、OH-的个数比8:1:2,则溶液中Na2SO4、NaCl、NaOH个数比为
A.1:1:1 B.1:4:2 C.1:2:4 D.1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。
(1)已知25℃时,Ksp(BaSO4)=1×10-10,将BaSO4的悬浊液过滤,滤液中c(Ba2+)=_______mol·L-1。取100 mL滤液与100 mL 2 mol·L-1的Na2SO4溶液混合,混合液中c(Ba2+)=___________ mol·L-1。
(2)长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为:_____________________________________________________
②请分析CaSO4转化为CaCO3的原理:______________________________________________________
Ⅱ.在25 ℃时,HSCN、HClO、H2CO3的电离常数如下表:
HClO | HSCN | H2CO3 |
K=3.2×10-8 | K=0.13 | K1=4.2×10-7 K2=5.6×10-11 |
(1)1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为_________________________________
(2)向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为_______________________________
(3)25 ℃时,为证明HClO为弱酸,某学习小组的同学设计了以下三种实验方案。下列三种方案中,你认为能够达到实验目的的是______________________(填下列各项中序号)。
a.用pH计测量0.1mol·L-1NaClO溶液的pH,若测得pH>7,可证明HClO为弱酸
b.用pH试纸测量0.01 mol·L-1 HClO溶液的pH,若测得pH>2,可证明HClO为弱酸
c.用仪器测量浓度均为0.1 mol·L-1的HClO溶液和盐酸的导电性,若测得HClO溶液的导电性弱于盐酸,可证明HClO为弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R、Q、W均为短周期主族元素,部分信息如下表所示:
X | Y | Z | M | R | Q | W | |
原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | 0.077 | ||
主要化合价 | -4,+4 | -2 | -1,+7 | +3 | -4,+4 | ||
其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(1)Y在元素周期表中的位置是_____。
(2)写出化合物XRM的电子式:_____;比较Z、M、R三种元素对应的简单离子半径大小_____。(用离子符号和“>”表示)
(3)Z与Q相比,金属性较强的是_____(用元素符号表示),下列事实能证明这一结论的是
_____(选填字母序号)。
a.Z的熔点低于Q
b.常温下,Z与水剧烈反应而Q不能
c.最高价氧化物对应的水化物碱性:ZOH > Q(OH)3
d.最外层电子数:Q > Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。
![]()
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
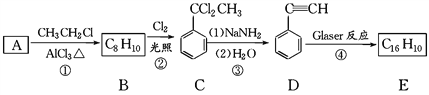
回答下列问题:
(1)B的结构简式为_______________,D的化学名称为________。
(2)①和③的反应类型分别为________、________。
(3)反应④ 化学反应方程式为______________________。
(4)下列说法不正确的是(____)
A.用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气4mol;
B.E分子中处于同一条直线上的原子最多有8个;
C.C分子的核磁共振氢谱面积比为1:2:2:3
D.可用酸性高锰酸钾溶液鉴别A和B
(5)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为:_______________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为:_______________________。
(6)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为 3∶1,符合该条件的同分异构体有_______种。
(7)写出用2苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线 _____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com