
【题目】硫酸是重要的化工产品,在基础化学试验中,有着重要的作用。
(1)质量分数为98%(密度1.84 g/cm3)的浓硫酸在实验室中常用作吸水剂,其物质的量浓度为_________。
(2)若用上述质量分数为98%的硫酸,配制480 mL物质的量浓度为2.3 mol/L的硫酸,所需浓硫酸的体积为_________ mL。
(3)取用任意体积的浓硫酸时,下列物理量中不变的是_________。
A.溶液中H2SO4的物质的量 B.溶液的浓度 C.溶液的质量 D.溶液的密度
(4)完成(2)中实验除了烧杯、量筒、玻璃棒外,还需要的仪器有_________。
(5)下列操作使所配溶液的物质的量浓度偏高的_________(填序号)。
A.用量筒量取浓H2SO4,慢慢地沿着玻璃棒注入盛有50 mL蒸馏水的小烧杯,搅拌后,立即转移到容量瓶中
B.往容量瓶转移溶液时,有少量液体溅出
C.未洗涤稀释浓H2SO4的小烧杯
D.定容时俯视
E.容量瓶未干燥即用来配制溶液
【答案】18.4 mol/L 62.5 BD 胶头滴管、500 mL容量瓶 AD
【解析】
(1)根据![]() ,质量分数为98%,密度1.84 g/cm3的浓硫酸的物质的量浓度为
,质量分数为98%,密度1.84 g/cm3的浓硫酸的物质的量浓度为![]() ;
;
(2)根据稀释前后物质的量不变可知,![]() ,
,![]() ,
,![]() ;
;
(3)取用任意体积的浓硫酸时,溶液的浓度和溶液的密度不变,选BD;
(4)配制一定物质的量浓度的溶液时需要烧杯、玻璃棒、一定规格的容量瓶、胶头滴管、量筒(或托盘天平),完成(2)中实验除了烧杯、量筒、玻璃棒外,还需要的仪器有胶头滴管和500 mL的容量瓶。
(5)A. 用量筒量取浓H2SO4,慢慢地沿着玻璃棒注入盛有50 mL蒸馏水的小烧杯,浓H2SO4溶于水放热,搅拌后,立即转移到容量瓶中,所配溶液的浓度偏大,选A;
B. 往容量瓶转移溶液时,有少量液体溅出,导致溶质的物质的量偏少,所配溶液的浓度偏小,不选B;
C. 未洗涤稀释浓H2SO4的小烧杯,导致溶质的物质的量偏少,所配溶液的浓度偏小,不选C;
D. 定容时俯视,溶液体积比实际体积小,溶液的浓度偏大,选D;
E. 容量瓶未干燥即用来配制溶液,不影响所配溶液的体积和溶质的物质的量,所配溶液的浓度不变,不选E。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为_________(填标号)。C、D中有气泡冒出,并可观察到的现象分别为_______________。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值。下列的说法中,正确的是( )
A. 4.6g金属钠由原子完全变为Na+ 离子时,失去的电子数为0.1NA
B. NA 个氧气分子与NA 个氢气分子的质量比为8︰1
C. 0.2 NA个硫酸分子与19.6g磷酸(相对分子质量:98)含有相同的氧原子数
D. 22.4L的氮气所含有的原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)顺铂(化学名称为顺二氯二氨合铂(II),化学式为PtCl2(NH3)2,相对分子质量为:300)是一种用于治疗癌症的药物,一片顺铂药片所含顺铂的质量为6×10-4g。那么一片顺铂药片中N原子的物质的量________;
(2)乙烯气体(C2H4)是石油化工产品之一,也是最重要的有机化工基础原料之一,在标准状况下其密度为_______g.L-1;(已知:标准状况下,Vm=22.4Lmol-1 )
(3)现有一种矿泉水样品,1.0升的该矿泉水含有4.8×10-2gMg2+。则________升矿泉水中含有1molMg2+;
(4)某“84消毒液”1000mL.其有效成分为NaClO(式量:74.5),质量分数为14.9%,密度为1.2g/L。其溶质的物质的量浓度为________;
(5)已知CO和CO2的混合气体7.2g。在标准状况下所占的体积为4.48L。则该混合气体中氧元素的质量为_______;
(6)如图所示两瓶体积相等的气体,在同温同压下,若瓶1两种气体______(填“物质的量”或者“质量”)相等,则两瓶中的气体原子总数和质量均相等。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O===O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是
A. H2O(g)===H2+1/2O2(g)ΔH=-485 kJ·mol-1
B. H2O(g)===H2(g)+1/2O2(g) ΔH=+485 kJ·mol-1
C. 2H2(g)+O2(g)===2H2O(g) ΔH=+485 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:

为了研究X的结构,将化合物A在一定条件下水解只得到 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语正确的是( )
A. 某元素基态原子的电子排布图![]()
B. NH4Cl电子式为[![]() :H]+Cl-
:H]+Cl-
C. Ca2+基态电子排布式为1s22s22p63s23p6
D. α羟基丙酸(乳酸)的比例模型为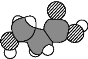
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化氢直接氧化法制氯气的反应是4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)。刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时,HCl平衡转化率随温度变化的关系如图所示。下列说法不正确的是( )
2Cl2(g)+2H2O(g)。刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时,HCl平衡转化率随温度变化的关系如图所示。下列说法不正确的是( )
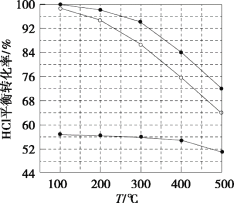
A.K(300℃)>K(400℃)
B.增加反应的压强和及时分离出氯气都可以提高氯化氢的转化率
C.当c(HCl):c(O2)进料比过低时,HCl的转化率较低,且不利于分离O2和Cl2
D.若HCl的初始浓度为c,进料比为1:1时,K(500℃)=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素的单质X、Y、Z在通常状况下均为气态,并有如图转化关系(反应条件略去)。已知X、Y、Z均为双原子单质,X是空气中含量最多的气体,甲可使湿润的酚酞试纸变红,乙溶于水即得盐酸。请完成下列问题:

(1)X的电子式是_________________。
(2)写出甲和乙反应的化学方程式__________________。
(3)实验室可用如图所示的装置(缺少收集装置,夹持固定装置略去)制备并收集甲。

①在图中方框内绘出收集甲的仪器装置简图。_______________
②试管中的试剂是________________(填写化学式)。
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com