
【题目】某兴趣小组以海水晒盐后的苦囟![]() 含有
含有![]() 为原料,设计制备碘单质
为原料,设计制备碘单质![]() 的转化途径如图,下列说法不正确的是
的转化途径如图,下列说法不正确的是

A.生活中可直接使用![]() 淀粉试纸检验加碘盐中是否含有碘
淀粉试纸检验加碘盐中是否含有碘
B.途径Ⅲ发生反应的离子方程式可能是![]()
C.由图可知氧化性的强弱顺序为![]()
D.两种途径得到等量的碘,消耗氯气物质的量比为1:5
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】通过下列装置可探究Cu2S(黑色)与O2的反应产物。下列说法错误的是
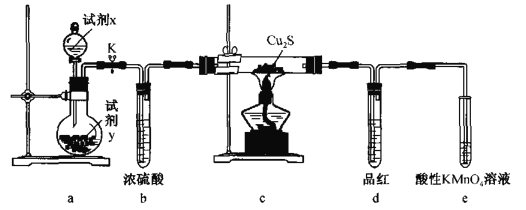
A.试剂x、y可分别选用H2O、Na2O2B.b、d的作用分别是干燥O2、检验SO2
C.若c中固体变红色,说明生成物为金属铜D.e中酸性KMnO4溶液可用NaOH溶液替代
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、O、S、Cl、Cu五种元素的单质及其化合物在现代工业生产中有着广泛应用。请回答下列问题:
(1)第一电离能:N_____O(填“![]() ”或“
”或“![]() ”,下同),电负性:S____Cl。
”,下同),电负性:S____Cl。
(2)![]() 的沸点比
的沸点比![]() 高的原因是___________;
高的原因是___________;![]() 属于________(填“极性”或“非极性”)分子,
属于________(填“极性”或“非极性”)分子,
(3)Cu与Cl形成化合物的晶胞如图所示。该晶体的化学式为________。
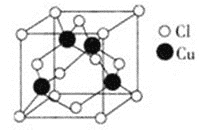
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下:
实验编号 | 实验温度/℃ | c(Na2S2O3)/mol·L-1 | V(Na2S2O3)/mL | c(H2SO4)/mol·L-1 | V(H2SO4)/mL | V(H2O)/mL |
① | 25 | 0.1 | 5.0 | 0.1 | 10.0 | a |
② | 25 | 0.1 | 10.0 | 0.1 | 10.0 | 0 |
③ | 25 | 0.2 | 5.0 | 0.1 | 5.0 | b |
④ | 50 | 0.2 | 5.0 | 0.1 | 10.0 | 5.0 |
其他条件不变时:探究温度对化学反应速率的影响,应选择实验__________(填实验编号);若同时选择实验①②、实验②③,测定混合液变浑浊的时间,可分别探究Na2S2O3浓度和H2SO4的浓度对化学反应速率的影响,则表中a和b分别为________和________。
(2)某同学设计如下实验流程探究Na2S2O3的化学性质。
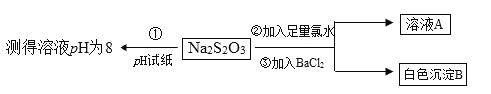
实验操作①中测试时pH试纸的颜色应该接近_____________。
A.红色 B.黄色 C.深蓝色 D.绿色
上述流程中实验②、③的目的是为了探究Na2S2O3某种化学性质,你认为是探究了Na2S2O3的_____性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向仅含Fe2+、I-、Br-的溶液中通入适量氯气,溶液中这三种离子的物质的量随消耗氯气物质的量的变化如下图所示。下列说法中正确的是( )
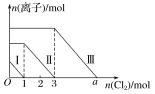
A.线段Ⅲ代表Fe2+的变化情况
B.线段Ⅰ代表Br-的变化情况
C.a值等于6
D.原混合溶液中n(FeBr2)=4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用铝土矿(含有氧化铝和杂质)生产氧化铝纯品的工业流程如下:
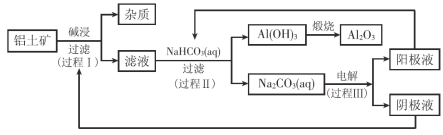
(1)过程I,发生反应的离子方程式是 。
(2)过程II,用一定浓度的NaHCO3溶液处理碱浸后滤液,所得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:
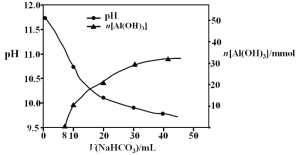
① 加入NaHCO3溶液体积小于8 mL时,发生主要反应的离子方程式是 。
② 过程II生成Al(OH)3的离子方程式是 。
(3)过程III,电解Na2CO3溶液的装置如下图所示。
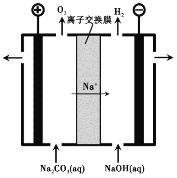
① 阴极的电极反应式是 。
② 简述阳极液生成的原理: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型镁-锂双离子二次电池如图,下列关于该电池的说法不正确的是

A. 放电时,Li+由左向右移动
B. 放电时,正极的电极反应式为Li1-xFePO4+xLi++xe-= LiFePO4
C. 充电时,外加电源的正极与Y相连
D. 充电时,导线上每通过1mol e-,左室溶液质量减轻12g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是光伏产业的一种关键化学原料,制备反应的方程式为Si(s)+3HCl(g)![]() SiHCl3(g)+H2(g),同时还有其他副反应发生。当反应体系的压强为0.05 MPa时,分别改变进料比[n(HCl)∶n(Si)]和反应温度,二者对SiHCl3产率影响如图所示。下列说法正确的是
SiHCl3(g)+H2(g),同时还有其他副反应发生。当反应体系的压强为0.05 MPa时,分别改变进料比[n(HCl)∶n(Si)]和反应温度,二者对SiHCl3产率影响如图所示。下列说法正确的是
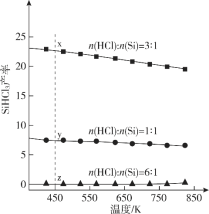
A. 降低压强有利于提高SiHCl3的产率
B. 制备SiHCl3的反应为放热反应
C. 温度为450 K,平衡常数:K(x)>K (y)>K (z)
D. 增加HCl的用量,SiHCl3的产率一定会增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学变化是有条件的。某小组同学探究I-与金属阳离子的氧化还原反应,实验过程如下。已知同浓度的稀溶液中氧化性:Ag+>Fe3+>Cu2+。
实狯 | 现象 | ||
| 编号 | 溶液x | |
I | 0.1mol/LFe(NO3)2,pH≈l | 溶液黄色立即加深,30秒后溶液变为褐色,无浑浊 | |
Ⅱ | KNO3和HNO3,其中c(NO3-)=0.3mol/L,pH≈1 | 1小时内溶液颜色始终保持无色 | |
Ⅲ | 0.1mol/LAgNO3 | 迅速变浑浊,离心分离后上层溶液为无色(经检测无I2),固体为黄色(AgI) | |
IV | 0.1mol/LCu(NO3)2 | 5秒后溶液由浅蓝色变为黄色并产生浑浊,离心分离后上层溶液为黄色(经检测有I2),固体为白色(CuI) | |
(1)根据实验I和Ⅱ,请回答下列问题。
①由“黄色立即加深”初步判断有I2生成,选择___(填试剂)进一步证实生成了I2。
②写出Fe3+与I-反应的离子方程式___,该条件下氧化性:Fe3+___I2(选填“>”或“<”)。
③实验Ⅱ的目的是___。
(2)实验Ⅳ中Cu2+与I-反应的离子方程式是___,甲同学得出氧化性:Cu2+>I2。
(3)乙同学认为甲同学的结论不合理,分析原因:实验Ⅲ应有I2生成,但却生成了AgI沉淀,因此推测实验Ⅳ中I2的生成,与CuI沉淀有关,故不能确定氧化性:Cu2+>I2,并用如图装置进行验证。K闭合后,较长时间发现两侧溶液均无明显变化。乙同学为了进一步判断Cu2+和I2的氧化性强弱,将左侧电极改为Cu电极,并向右侧溶液中加入少量___(填试剂),发现指针偏转,且左侧溶液颜色加深,证明该条件下氧化性:Cu2+___I2(选填“>”或“<”)。
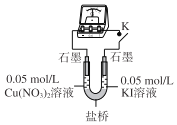
(4)该小组同学进一步分析认为,实验Ⅲ没有发生2Ag++2I-=2Ag+I2的反应,原因是生成AgI沉淀,反应物浓度迅速降低,不利于该反应进行;请分析实验Ⅳ发生氧化还原反应的原因是___。
(5)小组同学反思实验,反应体系中,各物质浓度对氧化还原反应是否发生都有一定的影响。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com